vaccin grippal inactivé à virion fragmenté
FORMES et PRÉSENTATIONS |
COMPOSITION |
| Virus de la grippe* (fragmenté, inactivé) des souches suivantes : | p dose (0,5 ml) |
| A/California/7/2009 (H1N1) souche dérivée utilisée : NYMC X-181 | 15 µg HA** |
| A/Perth/16/2009 (H3N2) souche analogue utilisée : NYMC X-187 dérivée de A/Victoria/210/2009 | 15 µg HA** |
| B/Brisbane/60/2008 | 15 µg HA** |
Ce vaccin est conforme aux recommandations de l’OMS (dans l’hémisphère Nord) et à la décision de l’Union européenne pour la saison 2010/2011.
* cultivé sur oeufs embryonnés de poules provenant d’élevages sains
** hémagglutinine
INDICATIONS |
POSOLOGIE ET MODE D’ADMINISTRATION |
- Adulte et enfant de plus de 36 mois :
- Une dose de 0,5 ml.
- Enfant de 6 mois à 35 mois :
- Les données cliniques sont limitées. Une dose de 0,25 ml ou de 0,5 ml a été utilisée.
Pour les enfants de moins de 9 ans n’ayant pas été vaccinés auparavant, une seconde dose devra être injectée après un intervalle d’au moins 4 semaines.
Coût de l’injection : 6,25 euro(s).Mode d’administration :
Administrer par voie intramusculaire ou sous-cutanée profonde.
Concernant le mode de préparation, cf Modalités de manipulation et d’élimination.
CONTRE-INDICATIONS |
- Hypersensibilité aux substances actives, à l’un des excipients et aux traces de substances contenues dans le vaccin, par exemple : oeufs, protéines de poulet comme l’ovalbumine.
- Le vaccin peut contenir des traces des substances suivantes : formaldéhyde, gentamicine ou désoxycholate de sodium.
- La vaccination doit être différée en cas de maladie fébrile ou d’infection aiguë.
MISES EN GARDE et PRÉCAUTIONS D’EMPLOI |
INTERACTIONS |
Fluarix peut être administré en même temps que d’autres vaccins. Cependant, les injections doivent être pratiquées sur deux membres différents. Il faut noter que les effets indésirables peuvent être intensifiés.
Examens paracliniques :
Après vaccination antigrippale, il a été observé des réponses faussement positives aux tests sérologiques utilisant la méthode Elisa pour détecter les anticorps contre HIV1, hépatite C et surtout HTLV1. Infirmées par le Western Blot, ces réactions transitoires faussement positives seraient dues à la réponse IgM induite par la vaccination.
GROSSESSE et ALLAITEMENT |
Le vaccin peut être administré en cas d’allaitement.
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
- Événements indésirables observés au cours des essais cliniques :
- La tolérance des vaccins grippaux trivalents inactivés est évaluée au cours d’essais cliniques en ouvert, non contrôlés, réalisés annuellement en conformité avec les exigences réglementaires, et incluant au moins 50 adultes âgés de 18 à 60 ans et au moins 50 personnes âgées de 61 ans et plus. L’évaluation de la tolérance est réalisée durant les 3 premiers jours suivant la vaccination.
- Les effets indésirables suivants (par classe d’organes) ont été observés au cours des essais cliniques selon les fréquences suivantes : très fréquent (>= 1/10) ; fréquent (>= 1/100, < 1/10) ; peu fréquent (>= 1/1000, < 1/100) ; rare (>= 1/10 000 ; < 1/1000) ; très rare (< 1/10 000), y compris les cas isolés.
- Affections du système nerveux :
- Fréquent : céphalées*.
- Fréquent : céphalées*.
- Affections de la peau et du tissu sous-cutané :
- Fréquent : sueurs*.
- Fréquent : sueurs*.
- Affections musculosquelettiques et systémiques :
- Fréquent : myalgies, arthralgies*.
- Fréquent : myalgies, arthralgies*.
- Troubles généraux et anomalies au site d’administration :
- Fréquent : fièvre, malaise, frissons, fatigue. Réactions locales : rougeur, gonflement, douleur, ecchymose, induration*.
- Fréquent : fièvre, malaise, frissons, fatigue. Réactions locales : rougeur, gonflement, douleur, ecchymose, induration*.
-
*
Ces réactions disparaissent généralement après 1 ou 2 jours sans traitement.
- Événements indésirables rapportés au cours de la surveillance après commercialisation :
- Les événements indésirables rapportés au cours de la surveillance après commercialisation, en plus de ceux déjà observés au cours des essais cliniques, sont les suivants :
- Affections hématologiques et du système lymphatique : thrombocytopénie transitoire, lymphadénopathie transitoire.
- Affections du système immunitaire : réactions allergiques, conduisant à un choc dans de rares cas, angioedème.
- Affections du système nerveux : névralgie, paresthésie, convulsions fébriles, troubles neurologiques, tels qu’encéphalomyélite, névrite et syndrome de Guillain-Barré.
- Affections vasculaires : vascularites avec atteinte rénale transitoire dans de très rares cas.
- Affections de la peau et du tissu sous-cutané : réactions cutanées généralisées incluant prurit, urticaire, rash non spécifique.
- Affections hématologiques et du système lymphatique : thrombocytopénie transitoire, lymphadénopathie transitoire.
SURDOSAGE |
PHARMACODYNAMIE |
Classe pharmacothérapeutique : Vaccin contre la grippe (code ATC : J07BB02).
La séroprotection est généralement obtenue dans les 2 à 3 semaines.
La durée de l’immunité postvaccinale vis-à-vis des souches homologues ou très proches des souches du vaccin est variable, mais elle est en général de 6 à 12 mois.
INCOMPATIBILITÉS |
En l’absence d’études de compatibilité, ce vaccin ne doit pas être mélangé avec d’autres produits injectables.
CONDITIONS DE CONSERVATION |
A conserver au réfrigérateur (entre + 2 °C et + 8 °C). Ne pas congeler. Conserver la seringue dans l’emballage extérieur à l’abri de la lumière.
MODALITÉS MANIPULATION/ÉLIMINATION |
Le vaccin doit avoir atteint la température ambiante avant utilisation.
Agiter avant l’emploi.
Lorsqu’une dose de 0,25 ml est indiquée, la seringue préremplie doit être maintenue en position verticale et la moitié du volume doit être éliminée jusqu’à ce que le bouchon-piston atteigne la ligne marquée sur la seringue. Le volume restant doit être injecté.
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
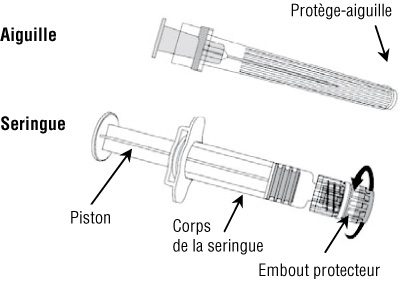
- Instructions pour l’administration du vaccin présenté en seringue préremplie sans aiguille sertie :
-
-
-
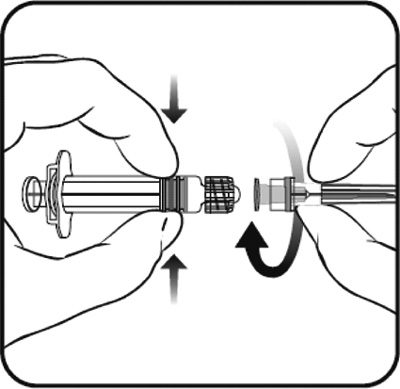
- En tenant le corps de la seringue d’une main (en évitant de tenir le piston), dévisser l’embout protecteur de la seringue en le tournant dans le sens inverse des aiguilles d’une montre.
- Pour fixer l’aiguille sur la seringue, visser l’aiguille dans le sens des aiguilles d’une montre sur la seringue jusqu’à sentir un blocage (cf schéma).
- Enlever le protège-aiguille, ce qui à l’occasion peut être un peu difficile.
- Administrer le vaccin.
- En tenant le corps de la seringue d’une main (en évitant de tenir le piston), dévisser l’embout protecteur de la seringue en le tournant dans le sens inverse des aiguilles d’une montre.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM | 3400934129735 (1976, RCP rév 10.09.2010). |
| Prix : | 6.25 euros (1 seringue de 0,5 ml). |
|
Remb Séc soc à 65 % selon les conditions de l’arrêté publié au Journal officiel le 10.11.2006. Collect. |
|
Laboratoire GlaxoSmithKline
100, route de Versailles. 78163 Marly-le-Roi cdx
Tél : 01 39 17 80 00
Info médic :
Tél : 01 39 17 84 44. Fax : 01 39 17 84 45
Pharmacovigilance : Tél : 01 39 17 80 16
Liste Des Sections Les Plus Importantes :
- pathologies
- Medicaments
- Medicaments injectables
- Traitement D’Urgence
- Guide Infirmier Des Examens De Laboratoire
- Infirmiers En Urgences
- Fiche Technique Medical
- Techniques De Manipulations En Radiologie Medicale
- Bibliotheque_medicale



