mémantine
Comprimé pelliculé à 10 mg (ovale, avec une ligne de sécabilité
* ; portant l’inscription « 10 » sur une face et « MM » sur l’autre face ; jaune pâle à jaune) : Boîte de 56, sous plaquettes thermoformées.
* Le comprimé peut être divisé en deux demi-doses égales.
Comprimé pelliculé à 20 mg (oblong, ovale, portant l’inscription « 20 » sur une face et l’inscription « MEM » sur l’autre ; rouge pâle à gris-rouge) : Boîte de 28, sous plaquettes thermoformées.
Modèles hospitaliers : Boîtes de 98, sous plaquettes thermoformées prédécoupées (conditionnements unitaires).
Solution buvable à 5 mg/pression (transparente et incolore à légèrement jaunâtre) : Flacon de 50 ml, avec pompe doseuse.
| Comprimé : | p cp |
Mémantine (DCI) chlorhydrate
| 10 mg |
| ou | 20 mg |
| (soit en mémantine : 8,31 mg/cp à 10 mg ; 16,62 mg/cp à 20 mg) |
Excipients (communs) :
Noyau : cellulose microcristalline, croscarmellose sodique, silice colloïdale anhydre, stéarate de magnésium. Pelliculage : hypromellose, macrogol 400, dioxyde de titane (E 171), oxyde de fer jaune (E 172), oxyde de fer rouge (E 172 ; cp à 20 mg).
| Solution buvable : | p pression* |
Mémantine (DCI) chlorhydrate
| 5 mg |
| (soit en mémantine : 4,16 mg/pression) |
Excipients : sorbate de potassium, sorbitol (E 420), eau purifiée.
Teneur en sorbitol : 100 mg/ml de solution.
Teneur en potassium : 0,5 mg/ml de solution.
*
Chaque activation de la pompe (une pression) délivre 0,5 ml de solution.
Traitement des patients atteints d’une forme modérée à sévère de la maladie d’Alzheimer.
POSOLOGIE ET MODE D’ADMINISTRATION
|
Le traitement doit être initié et supervisé par un médecin entraîné au diagnostic et au traitement de la maladie d’Alzheimer au stade démentiel. Le traitement ne doit commencer qu’avec l’assurance de la disponibilité d’un auxiliaire de soins qui surveillera régulièrement la prise du médicament par le patient. Le diagnostic doit être établi selon les critères en vigueur.
Ebixa doit être pris une fois par jour, à la même heure chaque jour. Les comprimés pelliculés ou la solution peuvent être pris pendant ou en dehors des repas. La solution ne doit pas être versée ou pompée directement dans la bouche à partir du flacon ou de la pompe mais elle doit être dosée dans une cuillère ou dans un verre d’eau en utilisant la pompe (pour des instructions détaillées sur la préparation et la manipulation de la solution buvable, cf Modalités de manipulation et d’élimination).
-
Adultes :
- Progression posologique :
- La dose maximale recommandée est de 20 mg par jour. Pour réduire le risque d’effets indésirables, cette dose est atteinte par une progression posologique de 5 mg par semaine au cours des trois premières semaines, en procédant comme suit :
- Semaine 1 (jours 1-7) : le patient doit prendre la moitié d’un comprimé pelliculé de 10 mg ou 0,5 ml de solution (soit 5 mg, équivalant à 1 pression) par jour pendant 7 jours.
-
- Semaine 2 (jours 8-14) : le patient doit prendre un comprimé pelliculé de 10 mg ou 1 ml de solution (soit 10 mg, équivalant à 2 pressions) par jour pendant 7 jours.
- Semaine 3 (jours 15-21) : le patient doit prendre un comprimé pelliculé et demi de 10 mg ou 1,5 ml de solution (soit 15 mg, équivalant à 3 pressions) par jour pendant 7 jours.
-
- À partir de la semaine 4 : le patient doit prendre deux comprimés pelliculés de 10 mg (ou un comprimé pelliculé de 20 mg) ou 2 ml de solution (soit 20 mg, équivalant à 4 pressions) par jour.
-
- Dose d’entretien : la dose d’entretien recommandée est de 20 mg par jour.
-
- Coût du traitement journalier : 3,17 euro(s) (cp à 10 mg et à 20 mg) ; 3,19 euro(s) (sol buv).
-
Personnes âgées :
- Sur la base des études cliniques, la dose recommandée pour les patients de plus de 65 ans est de 20 mg par jour (2 comprimés de 10 mg ou 1 comprimé de 20 mg) ou de 2 ml de solution (équivalant à 4 pressions), comme décrit ci-dessus.
-
Enfants et adolescents :
- Ebixa ne doit pas être utilisé chez l’enfant de moins de 18 ans en raison d’un manque de données concernant la sécurité et l’efficacité.
-
Insuffisance rénale :
- Chez les patients présentant une insuffisance rénale légère (clairance de la créatinine comprise entre 50 et 80 ml/min), aucune adaptation posologique n’est requise. Chez les patients présentant une insuffisance rénale modérée (clairance de la créatinine comprise entre 30 et 49 ml/min), la dose quotidienne doit être de 10 mg ou de 1 ml de solution (équivalant à 2 pressions). Si la tolérance est bonne après au moins 7 jours de traitement, la dose pourra être augmentée jusqu’à 20 mg par jour en suivant le schéma de progression posologique habituel. Chez les patients présentant une insuffisance rénale sévère (clairance de la créatinine comprise entre 5 et 29 ml/min), la dose quotidienne doit être de 10 mg ou de 1 ml de solution (équivalant à 2 pressions).
-
Insuffisance hépatique :
- Chez les patients présentant une insuffisance hépatique légère à modérée (Child-Pugh A et Child-Pugh B), aucune adaptation posologique n’est nécessaire. Aucune donnée concernant l’utilisation de la mémantine chez les patients présentant une insuffisance hépatique sévère n’est disponible. L’administration d’Ebixa n’est pas recommandée chez ce type de patients.
Hypersensibilité à la substance active ou à l’un des excipients.
MISES EN GARDE et PRÉCAUTIONS D’EMPLOI
|
- La prudence est recommandée chez les patients épileptiques, ayant des antécédents de convulsions, ou chez les patients présentant des facteurs de risque d’épilepsie.
-
- L’association aux antagonistes NMDA (N-méthyl-D-aspartate) tels que l’amantadine, la kétamine ou le dextrométhorphane doit être évitée. Ces composés agissent au niveau des mêmes récepteurs que la mémantine et, par conséquent, les effets indésirables (essentiellement liés au système nerveux central [SNC]) peuvent être plus fréquents ou plus prononcés (cf Interactions).
-
- Certains facteurs susceptibles d’augmenter le pH de l’urine (cf Pharmacocinétique : Élimination) peuvent exiger une surveillance étroite du patient. Ces facteurs incluent des modifications radicales du régime alimentaire, par exemple le passage d’un régime carné à un régime végétarien, ou l’ingestion massive de tampons gastriques alcalinisants. Le pH de l’urine peut également être élevé lors d’états d’acidose tubulaire rénale (ATR) ou d’infection urinaire sévère à Proteus.
-
- Dans la majorité des essais cliniques, les patients avec infarctus du myocarde récent, insuffisance cardiaque congestive non compensée (NYHA III-IV) ou hypertension artérielle non contrôlée étaient exclus. Par conséquent, les données disponibles sont limitées et les patients présentant ces pathologies doivent être étroitement surveillés.
-
-
Excipients de la solution buvable : La solution buvable contient du sorbitol. Les patients présentant une intolérance au fructose (maladie héréditaire rare) ne doivent pas prendre ce médicament.
-
Étant donné les effets pharmacologiques et le mode d’action de la mémantine, les interactions suivantes sont possibles :
- Le mode d’action suggère que les effets de la L-dopa, des agonistes dopaminergiques et des anticholinergiques peuvent être augmentés par un traitement associé avec des antagonistes NMDA tels que la mémantine. Les effets des barbituriques et des neuroleptiques peuvent être diminués. L’association de mémantine aux agents antispastiques, dantrolène ou baclofène, peut modifier leurs effets et un ajustement posologique de ces produits peut s’avérer nécessaire.
-
- L’association de mémantine et d’amantadine doit être évitée en raison du risque de psychose pharmacotoxique. Les deux composés sont des antagonistes NMDA chimiquement proches. C’est peut-être également le cas de la kétamine et du dextrométhorphane (cf Mises en garde et Précautions d’emploi). Il existe un cas publié concernant aussi un risque possible d’interaction lié à l’association mémantine et phénytoïne.
-
- D’autres substances actives telles que la cimétidine, la ranitidine, le procaïnamide, la quinidine, la quinine et la nicotine, qui utilisent le même système de transport cationique rénal que l’amantadine, pourraient également interagir avec la mémantine, entraînant une possible augmentation des taux plasmatiques.
-
- Il existe un risque de réduction des taux plasmatiques d’hydrochlorothiazide (HCT) lorsque la mémantine est administrée avec l’HCT ou toute association en contenant.
-
- Lors du suivi de pharmacovigilance après commercialisation, des cas isolés d’augmentation de l’INR (Rapport Normalisé International) ont été rapportés chez des patients traités de façon concomitante avec la warfarine. Bien qu’aucun lien de causalité n’ait été établi, une surveillance étroite du taux de prothrombine ou de l’INR est recommandée chez les patients traités de façon concomitante avec des anticoagulants oraux.
-
Dans des études de pharmacocinétique (PK) à dose unique chez des sujets sains jeunes, aucune interaction significative entre substances actives n’a été observée entre la mémantine et l’association glibenclamide/metformine ou le donépézil.
Dans une étude clinique chez des sujets sains jeunes, aucun effet significatif de la mémantine sur la pharmacocinétique de la galantamine n’a été observé.
In vitro, la mémantine n’a pas inhibé les CYP 1A2, 2A6, 2C9, 2D6, 2E1, 3A, la flavine mono-oxygénase, l’époxyde hydrolase ou la sulfatation.
Pour la mémantine, aucune donnée clinique sur les grossesses exposées n’est disponible. Les études chez l’animal indiquent un potentiel de réduction du développement intra-utérin à des niveaux d’exposition identiques ou légèrement supérieurs à l’exposition humaine (cf Sécurité préclinique). Le risque demeure inconnu pour l’être humain. La mémantine ne doit pas être utilisée durant la grossesse, sauf cas de nécessité absolue.
Il n’a pas été établi si la mémantine est excrétée dans le lait maternel humain mais, étant donné la lipophilie de la substance, le passage est probable. Il est déconseillé aux femmes prenant de la mémantine d’allaiter.
CONDUITE et UTILISATION DE MACHINES
|
Une maladie d’Alzheimer modérée à sévère a généralement un impact important sur l’aptitude à conduire des véhicules et à utiliser des machines. De plus, Ebixa exerce une influence mineure à modérée sur l’aptitude à conduire des véhicules et à utiliser des machines ; les patients ambulatoires doivent donc être avertis de prendre des précautions particulières.
Au cours des essais cliniques dans la démence légère à sévère ayant inclus 1784 patients traités par Ebixa et 1595 patients sous placebo, la fréquence globale des événements indésirables pour Ebixa ne différait pas de celle du placebo ; les événements indésirables étaient en général d’intensité légère à modérée. Les événements indésirables les plus fréquents avec une incidence supérieure dans le groupe Ebixa par rapport au groupe placebo ont été : sensations vertigineuses (6,3 % vs 5,6 %, respectivement), céphalée (5,2 % vs 3,9 %), constipation (4,6 % vs 2,6 %), somnolence (3,4 % vs 2,2 %) et hypertension (4,1 % vs 2,8 %).
Les effets indésirables dans le tableau ci-dessous ont été recueillis au cours des essais cliniques avec Ebixa et depuis sa commercialisation. Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Les effets indésirables sont classés par classes systèmes organes en appliquant les conventions suivantes : très fréquent (>= 1/10), fréquent (>= 1/100, < 1/10), peu fréquent (>= 1/1000, < 1/100), rare (>= 1/10 000, < 1/1000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
| Infections et infestations | Peu fréquent | Infections fongiques |
| Affections du système immunitaire | Fréquent | Hypersensibilité au médicament |
| Affections psychiatriques | Fréquent | Somnolence |
| Peu fréquent | Confusion, hallucinations* |
| Fréquence indéterminée | Réactions psychotiques** |
| Affections du système nerveux | Fréquent | Sensations vertigineuses |
| Peu fréquent | Troubles de la marche |
| Très rare | Convulsions |
| Affections cardiaques | Peu fréquent | Insuffisance cardiaque |
| Affections vasculaires | Fréquent | Hypertension |
| Peu fréquent | Thrombose veineuse/thromboembolisme |
| Affections respiratoires, thoraciques et médiastinales | Fréquent | Dyspnée |
| Affections gastro–intestinales | Fréquent | Constipation |
| Peu fréquent | Vomissements |
| Fréquence indéterminée | Pancréatite** |
| Troubles généraux et anomalies au site d’administration | Fréquent | Céphalée |
| Peu fréquent | Fatigue |
*
Les hallucinations ont été observées principalement chez les patients au stade sévère de la maladie d’Alzheimer.
**
Cas isolés rapportés au cours du suivi de pharmacovigilance.
La maladie d’Alzheimer a été associée à des cas de dépression, d’idées suicidaires et de suicide. Lors du suivi de pharmacovigilance après commercialisation, ces événements ont été rapportés chez des patients traités par Ebixa.
Les données concernant le surdosage au cours des essais cliniques et du suivi de pharmacovigilance après commercialisation sont limitées.
-
Symptômes :
- Des surdosages relativement importants (200 mg et 105 mg par jour pendant 3 jours, respectivement) ont été associés soit aux seuls symptômes fatigue, faiblesse et/ou diarrhée, soit à l’absence de symptômes. Dans les cas de surdosages inférieurs à 140 mg ou dont la dose est inconnue, les patients ont présenté des troubles du système nerveux central (confusion, sensation ébrieuse, somnolence, vertige, agitation, agressivité, hallucination et troubles de la marche) et/ou des troubles gastro-intestinaux (vomissement et diarrhée).
- Dans le cas le plus extrême de surdosage, le patient a survécu à la prise orale totale de 2000 mg de mémantine et présenté des troubles du système nerveux central (10 jours de coma suivis d’une diplopie et d’une agitation). Le patient a reçu un traitement symptomatique et des plasmaphérèses. Le patient a guéri sans séquelles permanentes.
- Dans un autre cas de surdosage important, le patient a également survécu et guéri. Le patient avait reçu 400 mg de mémantine par voie orale. Le patient a présenté des troubles du système nerveux central tels qu’hyperactivité motrice, psychose, hallucinations visuelles, état proconvulsif, somnolence, stupeur et perte de connaissance.
-
Traitement :
- En cas de surdosage, le traitement doit être symptomatique. Aucun antidote spécifique en cas d’intoxication ou de surdosage n’est disponible. Des moyens de prise en charge habituels pour éliminer la substance active tels que lavage gastrique, charbon activé (interruption d’un potentiel cycle entérohépatique), acidification des urines, diurèse forcée doivent être utilisés en fonction des besoins. En cas de signes et de symptômes d’hyperstimulation générale du système nerveux central (SNC), un traitement symptomatique sous étroite surveillance doit être envisagé.
Classe pharmacothérapeutique : autres médicaments antidémence (code ATC : N06DX01).
Il apparaît de plus en plus clairement que le dysfonctionnement de la neurotransmission glutamatergique, en particulier au niveau des récepteurs NMDA, contribue à la fois à l’expression des symptômes et à la progression de la maladie dans la démence neurodégénérative.
La mémantine est un antagoniste voltage-dépendant non compétitif des récepteurs NMDA d’affinité modérée. Elle module les effets de taux élevés pathologiques de glutamate qui pourraient aboutir à un dysfonctionnement neuronal.
-
Études cliniques :
- Une étude pivot en monothérapie dans une population de patients atteints de maladie d’Alzheimer au stade modéré à sévère (score total du Mini Mental Test [MMSE] de 3 à 14 au début de l’étude) a inclus un total de 252 patients ambulatoires. L’étude a montré le bénéfice du traitement par la mémantine par rapport au placebo à 6 mois (analyse des cas observés pour la Clinician’s Interview Based Impression of Change [CIBIC-plus] : p = 0,025 ; l’Alzheimer’s Disease Cooperative Study-Activities of Daily Living [ADCS-ADLsev] : p = 0,003 ; la Severe Impairment Battery [SIB] : p = 0,002).
- Une étude pivot en monothérapie dans le traitement de la maladie d’Alzheimer au stade léger à modéré (score total MMSE de 10 à 22 au début de l’étude) a inclus un total de 403 patients. Les patients traités par la mémantine ont présenté, de façon statistiquement significative, un effet supérieur à celui observé chez les patients sous placebo sur les critères primaires : Alzheimer’s Disease Assessment Scale ([ADAS-cog] ; p = 0,003) et CIBIC-plus (p = 0,004) à la semaine 24 (LOCF – dernière observation reportée). Dans une autre étude de monothérapie dans la maladie d’Alzheimer au stade léger à modéré, un total de 470 patients (score total MMSE de 11 à 23 au début de l’étude) ont été randomisés. L’analyse primaire définie de façon prospective n’a pas permis de conclure à une différence statistiquement significative sur le critère primaire d’efficacité à la semaine 24.
- Une méta-analyse des patients atteints d’une maladie d’Alzheimer au stade modéré à sévère (score total MMSE < 20) issue de 6 études de phase III versus placebo sur une durée de 6 mois (incluant les études en monothérapie et les études chez des patients traités par inhibiteurs de l’acétylcholinestérase à posologie stable) a montré un effet statistiquement significatif en faveur de la mémantine pour les domaines cognitif, global et fonctionnel. Chez les patients pour lesquels une aggravation concomitante sur les trois domaines était identifiée, les résultats ont montré un effet statistiquement significatif de la mémantine sur la prévention de l’aggravation, puisque 2 fois plus de patients sous placebo ont montré une aggravation dans les trois domaines par rapport à ceux traités par la mémantine (21 % vs 11 %, p < 0,0001).
-
Absorption :
- La mémantine présente une biodisponibilité absolue d’environ 100 %. Le Tmax se situe entre 3 et 8 heures. Rien n’indique que la prise de nourriture influe sur l’absorption de mémantine.
-
Distribution :
- Des doses quotidiennes de 20 mg aboutissent à des concentrations plasmatiques de mémantine à l’état d’équilibre comprises entre 70 et 150 ng/ml (0,5 à 1 µmol) avec d’importantes variations interindividuelles. Avec des doses quotidiennes de 5 à 30 mg, on a calculé un rapport moyen de 0,52 entre le liquide céphalorachidien (LCR) et le sérum. Le volume de distribution se situe autour de 10 l/kg. Environ 45 % de la mémantine est liée aux protéines plasmatiques.
-
Métabolisme :
- Chez l’homme, environ 80 % de la dose est présente sous forme inchangée. Les principaux métabolites chez l’homme sont le N-3,5-diméthyl-gludantan, le mélange isomère de 4- et 6-hydroxy-mémantine et le 1-nitroso-3,5-diméthyl-adamantane. Aucun de ces métabolites ne présente d’activité antagoniste NMDA. Aucun métabolisme catalysé par le cytochrome P450 n’a été détecté in vitro.
- Dans une étude avec administration par voie orale de 14C-mémantine, 84 % de la dose, en moyenne, a été retrouvée dans les 20 jours, dont plus de 99 % par excrétion rénale.
-
Élimination :
- La mémantine est éliminée de manière mono-exponentielle avec un t½ terminal de 60 à 100 heures. Chez les volontaires présentant une fonction rénale normale, la clairance totale (Cltot) s’élève à 170 ml/min/1,73 m2, et une partie de la clairance rénale totale se fait par sécrétion tubulaire.
- La clairance rénale fait également intervenir une réabsorption tubulaire, probablement par l’intermédiaire des protéines assurant le transport des cations. Le taux d’élimination rénale de la mémantine dans des urines alcalines peut être réduit d’un facteur de 7 à 9 (cf Mises en garde et Précautions d’emploi). L’alcalinisation de l’urine peut résulter de modifications radicales du régime alimentaire, par exemple du passage d’un régime carné à un régime végétarien, ou de l’ingestion massive de tampons gastriques alcalinisants.
-
Linéarité :
- Les études chez des volontaires ont montré une pharmacocinétique linéaire dans l’intervalle de dose allant de 10 à 40 mg.
-
Relation pharmacocinétique/pharmacodynamie :
- Avec une dose de mémantine de 20 mg par jour, les taux dans le LCR correspondent à la valeur ki (ki = constante d’inhibition) de la mémantine, soit 0,5 µmol dans le cortex frontal humain.
Les études à court terme chez le rat ont montré que la mémantine, comme les autres antagonistes NMDA, induisait une vacuolisation neuronale et une nécrose (lésions d’Olney) uniquement à des doses aboutissant à de très fortes concentrations sériques. Une ataxie et d’autres signes précliniques ont précédé la vacuolisation et la nécrose. Étant donné que ces effets n’ont pas été observés dans des études au long cours, ni chez les rongeurs, ni chez les non-rongeurs, la pertinence clinique de ces observations est inconnue.
Des modifications oculaires ont été observées de manière inconstante lors d’études de toxicité à doses répétées chez les rongeurs et le chien, mais pas chez le singe. Les examens ophtalmologiques spécifiques réalisés durant les études cliniques de la mémantine n’ont révélé aucune modification oculaire.
Une phospholipidose dans les macrophages pulmonaires causée par l’accumulation de mémantine dans les lysosomes a été observée chez les rongeurs. Cet effet est connu pour d’autres substances actives dotées de propriétés amphiphiliques cationiques. Il existe peut-être un lien entre cette accumulation et la vacuolisation observée dans les poumons. Cet effet a uniquement été observé à de fortes doses chez les rongeurs. La pertinence clinique de ces observations est inconnue.
Aucune génotoxicité n’a été observée suite aux études standard de la mémantine. Aucun effet carcinogène n’a été observé lors d’études vie entière chez la souris et le rat. La mémantine ne s’est pas avérée tératogène chez le rat et le lapin, même à des doses maternotoxiques, et aucun effet indésirable de la mémantine sur la fertilité n’a été relevé. Chez le rat, un retard de croissance du foetus a été constaté à des niveaux d’exposition identiques ou légèrement supérieurs à ceux utilisés chez l’homme.
MODALITÉS DE CONSERVATION
|
-
Comprimés pelliculés :
-
-
Durée de conservation :
- 4 ans.
- Pas de précautions particulières de conservation.
-
Solution buvable :
-
-
Durée de conservation :
- 4 ans.
- A conserver à une température ne dépassant pas 30 °C.
- Conserver et transporter le flacon avec la pompe fixée uniquement en position verticale.
-
-
Après ouverture :
- Utiliser le contenu du flacon sous 3 mois.
MODALITÉS MANIPULATION/ÉLIMINATION
|
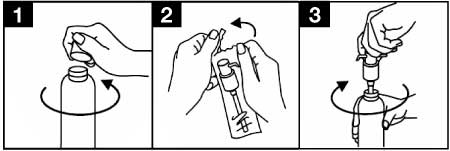
Avant la première utilisation, la pompe doseuse doit être vissée sur le flacon. Pour enlever le bouchon à vis du flacon, celui-ci doit être tourné dans le sens inverse des aiguilles d’une montre et dévissé complètement (figure 1).
-
Mise en place de la pompe doseuse sur le flacon :
- La pompe doseuse doit être retirée de son emballage plastique (figure 2) et insérée dans la partie haute du flacon, en glissant avec précaution le tube en plastique creux dans le flacon. Ensuite, maintenir la pompe doseuse avec l’encolure du flacon et visser la pompe dans le sens des aiguilles d’une montre jusqu’à ce qu’elle soit fermement fixée (figure 3). Pour son emploi, la pompe doseuse est vissée une fois seulement en début d’utilisation et ne doit jamais être dévissée.
-
-
Utilisation de la pompe doseuse pour administration :
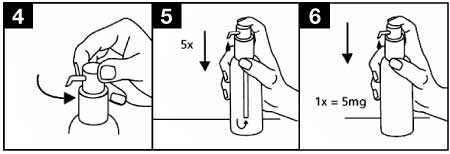
- La tête de la pompe doseuse a deux positions et est facile à tourner soit dans le sens inverse des aiguilles d’une montre (position déverrouillée) soit dans le sens des aiguilles d’une montre (position verrouillée). En position verrouillée, la tête de la pompe doseuse ne peut être actionnée vers le bas. La solution ne peut être délivrée qu’en position déverrouillée. Pour ce faire, tourner la tête de la pompe doseuse dans le sens de la flèche approximativement d’un huitième de tour, jusqu’à sentir une résistance (figure 4). La pompe doseuse est ainsi prête à l’emploi.
-
Préparation de la pompe doseuse :
- Quand elle est actionnée pour la première fois, la pompe doseuse ne délivre pas la quantité correcte de solution buvable. De ce fait, la pompe doit être préparée (amorcée) en actionnant complètement la tête de la pompe doseuse vers le bas cinq fois de suite (figure 5). La solution ainsi délivrée doit être jetée. A la prochaine pression de la tête de la pompe doseuse vers le bas et de façon complète, la dose adéquate est dispensée (1 pression est équivalente à 0,5 ml de solution buvable et contient environ 5 mg de chlorhydrate de mémantine, la substance active) : figure 6.
-
-
Utilisation correcte de la pompe doseuse :
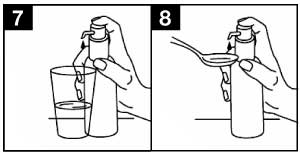
- Placer le flacon sur une surface plane et horizontale, par exemple sur une table, et ne l’utiliser qu’en position verticale. Tenir un verre contenant un peu d’eau ou une cuillère sous le bec verseur et presser la tête de la pompe doseuse d’un mouvement ferme, délicat et continu (pas trop lentement) vers le bas jusqu’à la butée (figures 7 et 8).
-
- La tête de la pompe doseuse peut alors être relâchée et la pompe est prête pour la pression suivante.
- La pompe doseuse ne peut être utilisée qu’avec la solution de chlorhydrate de mémantine contenue dans le flacon fourni et pas avec d’autres substances ou d’autres flacons. Si la pompe ne fonctionne pas comme décrit au cours de son utilisation ni en suivant les instructions, le patient doit consulter son médecin traitant ou un pharmacien. La pompe doseuse doit être verrouillée après utilisation.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE
|
LISTE I
| Surveillance particulière nécessaire pendant le traitement. |
| Prescription initiale annuelle réservée aux médecins spécialistes en neurologie, en psychiatrie, aux médecins spécialistes titulaires du diplôme d’études spécialisées complémentaires de gériatrie et aux médecins spécialistes ou qualifiés en médecine générale titulaires de la capacité de gérontologie. |
| AMM | EU/1/02/219/008 ; CIP 3400935955319 (2002, RCP rév 25.10.2010) 56 cp à 10 mg. |
| EU/1/02/219/015 ; CIP 3400957077969 (2006, RCP rév 25.10.2010) 98 × 1 cp à 10 mg. |
| EU/1/02/219/024 ; CIP 3400938740301 (2008, RCP rév 25.10.2010) 28 cp à 20 mg. |
| EU/1/02/219/046 ; CIP 3400957370534 (2008, RCP rév 25.10.2010) 98 × 1 cp à 20 mg. |
| EU/1/02/219/005 ; CIP 3400935955609 (2002, RCP rév 25.10.2010) sol buv. |
| | |
| Prix : | 88.80 euros (56 comprimés à 10 mg). |
| 88.80 euros (28 comprimés à 20 mg). |
| 79.84 euros (flacon de 50 ml). |
| Remb Séc soc à 65 %. Collect. |
| Modèles hospitaliers : Collect. |
|
Titulaire de l’AMM : H. Lundbeck A/S, Ottiliavej 9, DK-2500 Valby, Danemark.
LUNDBECK SAS
37-45, quai du Président-Roosevelt
92445 Issy-les-Moulineaux cdx
Tél : 01 79 41 29 00
Info médic et Pharmacovigilance :
Tél : 01 79 41 29 79
Liste Des Sections Les Plus Importantes :
Pour plus des conseils sur cette application et developpement de cette dernier contacter avec moi dans ma emaile support@mededuct.com