rispéridone
FORMES et PRÉSENTATIONS |
COMPOSITION |
| Poudre : | p flacon |
| Rispéridone (DCI) | 25 mg |
| ou | 37,5 mg |
| ou | 50 mg |
Solvant : acide citrique anhydre, phosphate disodique dihydraté, polysorbate 20, carmellose sodique, chlorure de sodium, hydroxyde de sodium, eau ppi.
INDICATIONS |
POSOLOGIE ET MODE D’ADMINISTRATION |
- Adulte :
-
- Dose initiale :
- Pour la majorité des patients, la dose recommandée est de 25 mg par voie intramusculaire toutes les 2 semaines. Chez les patients traités par une dose fixe de rispéridone orale depuis 2 semaines ou plus, le schéma de conversion suivant doit être pris en compte. Les patients traités par une dose inférieure ou égale à 4 mg de rispéridone orale doivent recevoir Risperdalconsta LP 25 mg ; chez les patients traités par des doses orales plus élevées, la dose plus élevée de Risperdalconsta LP 37,5 mg doit être envisagée.
- Lorsque les patients ne sont pas actuellement sous traitement par la rispéridone orale, la posologie du prétraitement oral doit être prise en compte dans le choix de la dose initiale IM. La dose initiale recommandée est de 25 mg de Risperdalconsta LP toutes les deux semaines. Pour les patients recevant des doses plus élevées de l’antipsychotique oral en cours, la dose plus élevée de Risperdalconsta LP 37,5 mg doit être envisagée.
- Une couverture antipsychotique suffisante par la rispéridone orale ou le traitement antipsychotique antérieur doit être assurée du fait d’un délai de latence de 3 semaines après la première injection de Risperdalconsta LP (cf Pharmacocinétique).
- Risperdalconsta LP ne doit pas être utilisé dans les exacerbations aiguës de la schizophrénie sans assurer une couverture antipsychotique suffisante par la rispéridone orale ou l’antipsychotique antérieur pendant la période de latence de 3 semaines suivant la première injection de Risperdalconsta LP.
-
- Dose d’entretien :
- Pour la majorité des patients, la dose recommandée est de 25 mg par voie intramusculaire toutes les 2 semaines. Certains patients peuvent bénéficier des doses plus élevées de 37,5 mg ou 50 mg. Un ajustement posologique à une dose supérieure ne doit pas être réalisé plus fréquemment que toutes les 4 semaines.
- L’effet de cette augmentation de dose ne doit pas être attendu avant un délai de 3 semaines après la première injection à la dose plus élevée. Aucun bénéfice supplémentaire n’a été observé à la dose de 75 mg dans les essais cliniques. Des doses supérieures à 50 mg toutes les 2 semaines ne sont pas recommandées.
- Coût du traitement journalier : 8,69 euro(s) (25 mg) ; 11,18 euro(s) (37,5 mg) ; 13,63 euro(s) (50 mg).
- Sujet âgé :
- Aucun ajustement posologique n’est nécessaire. La dose recommandée est de 25 mg par voie intramusculaire toutes les 2 semaines. Lorsque les patients ne sont pas actuellement traités par la rispéridone orale, la dose recommandée est de 25 mg de Risperdalconsta LP toutes les 2 semaines. Pour les patients recevant une dose fixe de rispéridone orale depuis 2 semaines ou plus, le schéma de conversion suivant doit être pris en compte. Les patients traités par une dose inférieure ou égale à 4 mg de rispéridone orale doivent recevoir Risperdalconsta LP 25 mg, pour les patients traités par des doses orales plus élevées, la dose plus élevée de Risperdalconsta LP 37,5 mg doit être envisagée.
- Une couverture antipsychotique suffisante doit être assurée pendant la période de latence de 3 semaines après la première injection de Risperdalconsta LP (cf Pharmacocinétique). Les données cliniques avec Risperdalconsta LP sont limitées chez les sujets âgés. Risperdalconsta LP sera utilisé avec prudence chez les sujets âgés.
- Insuffisance hépatique et insuffisance rénale :
- Risperdalconsta LP n’a pas été étudié chez les patients présentant une insuffisance hépatique ou rénale.
- En cas de nécessité de traitement par Risperdalconsta LP chez des patients insuffisants hépatiques ou rénaux, une dose initiale de 0,5 mg 2 fois par jour de rispéridone orale est recommandée pendant la première semaine. La deuxième semaine, 1 mg 2 fois par jour ou 2 mg 1 fois par jour peuvent être administrés. Lorsqu’une dose orale journalière totale d’au moins 2 mg est bien tolérée, une injection de 25 mg de Risperdalconsta LP peut être administrée toutes les 2 semaines.
- Une couverture antipsychotique suffisante doit être assurée pendant la période de latence de 3 semaines après la première injection de Risperdalconsta LP (cf Pharmacocinétique).
- Usage pédiatrique :
- Risperdalconsta LP n’est pas recommandé chez les enfants de moins de 18 ans en l’absence de données de sécurité d’emploi et d’efficacité.
Mode d’administration :
Risperdalconsta LP doit être administré toutes les 2 semaines par injection intramusculaire profonde dans le muscle deltoïde ou fessier à l’aide de l’aiguille sécurisée appropriée. Pour une administration dans le muscle deltoïde, utiliser l’aiguille de 25 mm en alternant les injections entre les deux bras. Pour une administration dans le muscle fessier, utiliser l’aiguille de 50 mm en alternant les injections entre les deux muscles fessiers. Ne pas administrer par voie intraveineuse (cf Mises en garde et Précautions d’emploi, Modalités de manipulation et d’élimination).
Pour les instructions pour l’utilisation, la manipulation et l’élimination de Risperdalconsta LP, cf Modalités de manipulation et d’élimination.
CONTRE-INDICATIONS |
MISES EN GARDE et PRÉCAUTIONS D’EMPLOI |
- Patients âgés déments :
- Risperdalconsta LP n’a pas été étudié chez les patients âgés déments, en conséquence son utilisation n’est pas indiquée chez ce groupe de patients.
-
- Mortalité globale :
- Des patients âgés déments traités par des antipsychotiques atypiques ont présenté une augmentation de la mortalité comparativement au placebo dans une méta-analyse de 17 essais contrôlés réalisés avec des antipsychotiques atypiques, dont Risperdal oral. Dans des essais contrôlés versus placebo réalisés avec Risperdal oral dans cette population, l’incidence de la mortalité était de 4,0 % pour les patients traités par Risperdal comparés à 3,1 % pour les patients traités par placebo.
- L’odd ratio (Intervalle de confiance exact à 95 %) était de 1,21 (0,7 ; 2,1). L’âge moyen (extrêmes) des patients qui sont décédés était de 86 ans (extrêmes 67-100 ans).
-
- Utilisation concomitante de furosémide :
- Dans des essais contrôlés versus placebo réalisés avec Risperdal oral chez des patients âgés déments, une incidence plus élevée de la mortalité a été observée chez les patients traités par furosémide plus rispéridone (7,3 % ; âge moyen 89 ans, extrêmes 75-97 ans) comparativement aux patients traités par la rispéridone seule (3,1 % ; âge moyen 84 ans, extrêmes 70-96 ans) ou le furosémide seul (4,1 % ; âge moyen 80 ans, extrêmes 67-90 ans). L’augmentation de la mortalité chez les patients traités par furosémide plus rispéridone a été observée dans deux des quatre essais cliniques. L’utilisation concomitante de rispéridone avec d’autres diurétiques (principalement des diurétiques thiazidiques administrés à faible dose) n’a pas été associée à des observations similaires.
- Aucun mécanisme physiopathologique n’a été identifié pour expliquer cet effet, et aucun motif cohérent de décès n’a été observé. Toutefois, la prudence est nécessaire et le rapport risque/bénéfice de cette association ou d’un traitement concomitant par d’autres diurétiques puissants doit être pris en compte préalablement à toute décision d’utilisation. Il n’a pas été observé d’augmentation de la mortalité chez les patients prenant d’autres diurétiques comme traitement concomitant à la rispéridone. Indépendamment du traitement, la déshydratation est un facteur de risque de mortalité et doit donc être soigneusement évitée chez les patients âgés déments.
- Évènements indésirables cérébrovasculaires :
- Dans des essais contrôlés versus placebo réalisés chez des patients âgés déments, une incidence statistiquement plus élevée (environ 3 fois supérieure) des événements indésirables cérébrovasculaires, tels que des accidents vasculaires cérébraux (dont des décès) et des accidents ischémiques transitoires, a été observée chez des patients traités par la rispéridone comparativement aux patients recevant du placebo (âge moyen 85 ans ; extrêmes 73- 97 ans). L’analyse des données poolées de 6 essais contrôlés versus placebo menés principalement chez des patients âgés (> 65 ans) déments montre que les accidents cérébrovasculaires (graves et non graves, combinés) sont survenus chez 3,3 % (33/1009) des patients traités par la rispéridone et chez 1,2 % (8/712) des patients traités par placebo. L’odd ratio (intervalle de confiance exact à 95 %) était de 2,96 (1,34 ; 7,50). Le mécanisme de cette augmentation de risque n’est pas connu. Une augmentation du risque ne peut être exclue pour d’autres antipsychotiques ou d’autres populations de patients. Risperdalconsta LP doit être utilisé avec prudence chez les patients présentant des facteurs de risque d’accident vasculaire cérébral.
- Hypotension orthostatique :
- En raison des propriétés alphabloquantes de la rispéridone, une hypotension (orthostatique) peut survenir, principalement à l’initiation du traitement. Une hypotension cliniquement significative a été observée après commercialisation lors de l’utilisation concomitante de rispéridone et d’un traitement antihypertenseur. La rispéridone doit être utilisée avec prudence chez les patients présentant des risques cardiovasculaires connus (par exemple, insuffisance cardiaque, infarctus du myocarde, anomalies de la conduction, déshydratation, hypovolémie ou maladie cérébrovasculaire). Le rapport risque/bénéfice de la poursuite du traitement par Risperdalconsta LP doit être évalué lorsqu’une hypotension orthostatique cliniquement significative persiste.
- Dyskinésie tardive/Symptômes extrapyramidaux (DT/SEP) :
- Les médicaments qui possèdent des propriétés antagonistes dopaminergiques ont été associés à l’induction de dyskinésie tardive caractérisée par des mouvements anormaux involontaires, prédominant au niveau de la langue et/ou du visage. La survenue de symptômes extrapyramidaux est un facteur de risque de dyskinésie tardive. Si les signes et symptômes d’une dyskinésie tardive apparaissent, l’arrêt de tous les antipsychotiques doit être envisagé.
- Syndrome malin des neuroleptiques (SMN) :
- Le syndrome malin des neuroleptiques, caractérisé par une hyperthermie, une rigidité musculaire, une instabilité du système nerveux autonome, une altération de la conscience et une élévation des taux sériques de créatine phosphokinase, a été rapporté avec les antipsychotiques. Des signes cliniques supplémentaires peuvent inclure une myoglobinurie (rhabdomyolyse) et une insuffisance rénale aiguë. Dans ce cas, tous les antipsychotiques, dont Risperdalconsta LP, doivent être arrêtés.
- Maladie de Parkinson et démence à Corps de Lewy :
- Les prescripteurs doivent évaluer le rapport risque/bénéfice lors de la prescription d’antipsychotiques, dont Risperdalconsta LP, chez des patients présentant une maladie de Parkinson ou une démence à Corps de Lewy. La maladie de Parkinson peut s’aggraver sous rispéridone. Ces deux groupes de patients peuvent présenter une augmentation du risque de survenue d’un syndrome malin des neuroleptiques ainsi qu’une sensibilité accrue aux médicaments antipsychotiques ; ces patients étaient exclus des essais cliniques. Les symptômes de cette sensibilité accrue peuvent inclure une confusion, une somnolence, une instabilité posturale avec chutes fréquentes, en plus des symptômes extrapyramidaux.
- Hyperglycémie :
- Une hyperglycémie ou une exacerbation d’un diabète préexistant ont été rapportées dans de très rares cas au cours de traitement par Risperdalconsta LP. Un suivi clinique adéquat est recommandé chez les patients diabétiques et chez les patients présentant des facteurs de risque de développement d’un diabète sucré.
- Hyperprolactinémie :
- Les études sur cultures de tissus suggèrent que la croissance cellulaire peut être stimulée par la prolactine dans les tumeurs du sein chez l’homme. Bien qu’une association claire avec l’administration d’antipsychotiques n’ait pas été établie à ce jour dans les études cliniques et épidémiologiques, la prudence est recommandée chez les patients présentant des antécédents médicaux significatifs. Risperdalconsta LP doit être utilisé avec prudence chez les patients présentant des antécédents d’hyperprolactinémie et chez les patients présentant des tumeurs potentiellement prolactine-dépendantes.
- Allongement de l’intervalle QT :
- Un allongement de l’intervalle QT a été très rarement rapporté après commercialisation. Comme avec d’autres antipsychotiques, la prudence est nécessaire lorsque la rispéridone est prescrite à des patients présentant une maladie cardiovasculaire connue, des antécédents familiaux d’allongement de l’intervalle QT, une bradycardie, ou des troubles électrolytiques (hypokaliémie, hypomagnésémie), car ils peuvent augmenter le risque d’effets arythmogènes, ainsi qu’en cas d’utilisation concomitante de médicaments connus pour allonger l’intervalle QT.
- Convulsions :
- Risperdalconsta LP doit être utilisé avec prudence chez les patients présentant des antécédents de convulsions ou d’autres situations cliniques pouvant potentiellement abaisser le seuil épileptogène.
- Priapisme :
- Un priapisme peut survenir au cours du traitement par Risperdalconsta LP du fait de ses propriétés alpha-adrénergiques bloquantes.
- Régulation de la température corporelle :
- Une altération de la capacité corporelle à diminuer la température corporelle centrale a été rapportée avec les médicaments antipsychotiques. La prudence est recommandée en cas de prescription de Risperdalconsta LP à des patients susceptibles d’être exposés à certaines situations pouvant contribuer à une augmentation de la température corporelle centrale, par exemple exercice physique intense, exposition à une température extrême, traitement concomitant par des médicaments ayant une activité anticholinergique ou tendance à la déshydratation.
- Prise de poids :
- Comme pour tous les antipsychotiques, les patients doivent être informés du risque de prise de poids. Le poids doit être évalué régulièrement.
- Insuffisance rénale ou hépatique :
- Bien que l’administration de rispéridone orale ait été étudiée, Risperdalconsta LP n’a pas été étudié chez les patients insuffisants rénaux ou hépatiques. Risperdalconsta LP doit être administré avec prudence chez ce groupe de patients (cf Posologie et Mode d’administration).
- Administration :
- La prudence est nécessaire pour éviter toute injection accidentelle de Risperdalconsta LP dans un vaisseau sanguin.
- Excipients :
- Ce médicament contient moins d’1 mmol de sodium (23 mg) par injection, c’est-à-dire qu’il est essentiellement « sans sodium ».
INTERACTIONS |
Les études d’interactions ont été réalisées avec Risperdal oral.
- Effet de Risperdalconsta LP sur d’autres médicaments :
- La rispéridone doit être administrée avec prudence en association avec d’autres médicaments agissant au niveau central, en particulier l’alcool, les opiacés, les antihistaminiques et les benzodiazépines, du fait d’une augmentation du risque d’effet sédatif.
- Risperdalconsta LP peut antagoniser l’effet de la lévodopa et d’autres agonistes dopaminergiques. Lorsque l’association s’avère nécessaire, en particulier aux stades terminaux de la maladie de Parkinson, la dose minimale efficace de chaque traitement doit être prescrite.
- Une hypotension cliniquement significative a été observée après commercialisation lors de l’utilisation concomitante de rispéridone et d’un traitement anti-hypertenseur.
- Risperdal n’a pas montré d’effet cliniquement significatif sur la pharmacocinétique du lithium, du valproate, de la digoxine ou du topiramate.
- Effets potentiels d’autres médicaments sur Risperdalconsta LP :
- Une diminution des concentrations plasmatiques de la fraction antipsychotique active de la rispéridone a été observée avec la carbamazépine. Des effets similaires peuvent être observés par exemple avec la rifampicine, la phénytoïne et le phénobarbital qui sont aussi des inducteurs du CYP3A4 hépatique et de la P-glycoprotéine. Lorsque la carbamazépine ou d’autres inducteurs du CYP3A4 hépatique/P-glycoprotéine (P-gp) sont instaurés ou arrêtés, le prescripteur doit réévaluer la posologie de Risperdalconsta LP.
- La fluoxétine et la paroxétine, inhibiteurs du CYP2D6, augmentent les concentrations plasmatiques de rispéridone, mais à un moindre degré celles de la fraction antipsychotique active. D’autres inhibiteurs du CYP2D6, tels que la quinidine, peuvent modifier les concentrations plasmatiques de la rispéridone de la même façon. Lorsque l’administration concomitante de fluoxétine ou de paroxétine est instaurée ou arrêtée, le prescripteur doit réévaluer la posologie de Risperdalconsta LP.
- Le vérapamil, un inhibiteur du CYP3A4 et la P-gp, augmente les concentrations plasmatiques de rispéridone.
- La galantamine et le donépézil ne montrent pas d’effets cliniquement significatifs sur la pharmacocinétique de la rispéridone et de la fraction antipsychotique active.
- Les phénothiazines, les antidépresseurs tricycliques, et certains bêtabloquants peuvent augmenter les concentrations plasmatiques de rispéridone mais pas celles de la fraction antipsychotique active. L’amitriptyline ne modifie pas la pharmacocinétique de la rispéridone ou de la fraction antipsychotique active. La cimétidine et la ranitidine augmentent la biodisponibilité de la rispéridone, mais seulement de façon marginale celle de la fraction antipsychotique active. L’érythromycine, un inhibiteur du CYP3A4, ne modifie pas la pharmacocinétique de la rispéridone et de la fraction antipsychotique active.
- Cf Mises en garde et Précautions d’emploi sur l’augmentation de la mortalité chez le patient âgé dément recevant de façon concomitante du furosémide.
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Il n’existe pas de données adéquates sur l’utilisation de la rispéridone pendant la grossesse. Dans les données après commercialisation, des symptômes extrapyramidaux réversibles ont été observés chez le nouveau-né après utilisation de rispéridone au cours du dernier trimestre de la grossesse.
En conséquence, les nouveau-nés doivent faire l’objet d’un suivi attentif. La rispéridone n’a pas montré d’effet tératogène au cours des études réalisées chez l’animal mais d’autres types de toxicité sur la reproduction ont été observés (cf Sécurité préclinique). Le risque potentiel pour l’espèce humaine est inconnu. En conséquence, Risperdalconsta LP ne doit pas être utilisé au cours de la grossesse sauf en cas de nécessité manifeste.
Allaitement :
Au cours des études animales, la rispéridone et la 9-hydroxy-rispéridone sont excrétées dans le lait. Il a été démontré que la rispéridone et la 9-hydroxy-rispéridone étaient également excrétées dans le lait maternel en faibles quantités. Il n’y a pas de données disponibles sur les effets indésirables chez le nourrisson allaité. En conséquence, les avantages de l’allaitement doivent être évalués au regard des risques potentiels pour l’enfant.
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
- Évènements indésirables par système organe et fréquence :
- Investigations :
- Fréquent : électrocardiogramme anormal, augmentation de la prolactinémie*, augmentation de la glycémie, augmentation des enzymes hépatiques, augmentation des transaminases, augmentation de la gammaglutamyltransférase, prise de poids, perte de poids.
- Peu fréquent : allongement du QT sur l’électrocardiogramme.
- Fréquent : électrocardiogramme anormal, augmentation de la prolactinémie*, augmentation de la glycémie, augmentation des enzymes hépatiques, augmentation des transaminases, augmentation de la gammaglutamyltransférase, prise de poids, perte de poids.
- Affections cardiaques :
- Fréquent : bloc auriculoventriculaire, tachycardie.
- Peu fréquent : bloc de branche, fibrillation auriculaire, bradycardie, bradycardie sinusale, palpitations.
- Fréquent : bloc auriculoventriculaire, tachycardie.
- Affections hématologiques et du système lymphatique :
- Fréquent : anémie.
- Peu fréquent : thrombocytopénie, neutropénie.
- Inconnu : agranulocytose.
- Fréquent : anémie.
- Affections du système nerveux :
- Très fréquent : parkinsonisme**, akathisie**, céphalée.
- Fréquent : dyskinésie tardive, dystonie**, dyskinésie**, tremblement, somnolence, sédation, sensations de vertige.
- Peu fréquent : convulsion, syncope, vertige orthostatique, hypoesthésie, paresthésie, léthargie, hypersomnie.
- Très fréquent : parkinsonisme**, akathisie**, céphalée.
- Affections oculaires :
- Très fréquent : vision trouble, conjonctivite.
- Inconnu : occlusion de l’artère rétinienne.
- Très fréquent : vision trouble, conjonctivite.
- Affections de l’oreille et du labyrinthe :
- Fréquent : vertige.
- Peu fréquent : otalgie.
- Fréquent : vertige.
- Affections respiratoires, thoraciques et médiastinales :
- Fréquent : dyspnée, toux, congestion nasale, douleur pharyngolaryngée.
- Rare : syndrome d’apnées du sommeil.
- Fréquent : dyspnée, toux, congestion nasale, douleur pharyngolaryngée.
- Affections gastro-intestinales :
- Fréquent : vomissements, diarrhée, constipation, nausée, douleur abdominale, dyspepsie, douleur dentaire, sécheresse buccale, gêne gastrique, gastrite.
- Rare : occlusion intestinale, pancréatite.
- Fréquent : vomissements, diarrhée, constipation, nausée, douleur abdominale, dyspepsie, douleur dentaire, sécheresse buccale, gêne gastrique, gastrite.
- Affections du rein et des voies urinaires :
- Fréquent : incontinence urinaire.
- Fréquent : incontinence urinaire.
- Affections de la peau et du tissu sous-cutané :
- Fréquent : éruption, eczéma.
- Peu fréquent : oedème angioneurotique, prurit, acné, alopécie, sécheresse cutanée.
- Fréquent : éruption, eczéma.
- Affections musculosquelettiques et systémiques :
- Fréquent : arthralgie, douleur dorsale, douleur des extrémités, myalgie.
- Peu fréquent : faiblesse musculaire, douleur cervicale, douleur du muscle fessier, douleur thoracique musculosquelettique.
- Fréquent : arthralgie, douleur dorsale, douleur des extrémités, myalgie.
- Affections endocriniennes :
- Rare : sécrétion inappropriée de l’hormone antidiurétique.
- Rare : sécrétion inappropriée de l’hormone antidiurétique.
- Troubles du métabolisme et de la nutrition :
- Peu fréquent : augmentation de l’appétit, diminution de l’appétit.
- Très rare : diabète acidocétosique.
- Inconnu : polydipsie.
- Peu fréquent : augmentation de l’appétit, diminution de l’appétit.
- Infections et infestations :
- Très fréquent : infection des voies respiratoires hautes.
- Fréquent : pneumonie, grippe, infection des voies respiratoires basses, bronchite, infection urinaire, infection auriculaire, sinusite, infection virale.
- Peu fréquent : cystite, gastro-entérite, infection, infection localisée, abcès sous-cutané.
- Très fréquent : infection des voies respiratoires hautes.
- Lésions, intoxications et complications liées aux procédures :
- Fréquent : chute.
- Peu fréquent : douleur à l’injection.
- Fréquent : chute.
- Affections vasculaires :
- Fréquent : hypertension, hypotension.
- Peu fréquent : hypotension orthostatique.
- Fréquent : hypertension, hypotension.
- Troubles généraux et anomalies au site d’administration :
- Fréquent : fièvre, oedème périphérique, douleur thoracique, fatigue, douleur, douleur au site d’injection, asthénie, syndrome grippal.
- Peu fréquent : induration au site d’injection, induration, réaction au site d’injection, gène thoracique, lenteur, sentiment d’anormalité.
- Rare : hypothermie.
- Fréquent : fièvre, oedème périphérique, douleur thoracique, fatigue, douleur, douleur au site d’injection, asthénie, syndrome grippal.
- Affections du système immunitaire :
- Peu fréquent : hypersensibilité.
- Inconnu : réaction anaphylactique.
- Peu fréquent : hypersensibilité.
- Affections hépatobiliaires :
- Rare : ictère.
- Rare : ictère.
- Affections des organes de reproduction et du sein :
- Fréquent : aménorrhée, dysfonctionnement érectile, galactorrhée.
- Peu fréquent : dysfonctionnement sexuel, gynécomastie.
- Inconnu : priapisme.
- Fréquent : aménorrhée, dysfonctionnement érectile, galactorrhée.
- Affections psychiatriques :
- Très fréquent : dépression, insomnie, anxiété.
- Fréquent : agitation, troubles du sommeil.
- Peu fréquent : manie, diminution de la libido, nervosité.
- Très fréquent : dépression, insomnie, anxiété.
* L’hyperprolactinémie peut dans certains cas induire une gynécomastie, des troubles menstruels, une aménorrhée, une galactorrhée.
** Un trouble extrapyramidal peut survenir : parkinsonisme (hypersécrétion salivaire, raideur musculosquelettique, parkinsonisme, salivation, [phénomène de] roue dentée, bradykinésie, hypokinésie, expression figée du visage, contracture musculaire, akinésie, rigidité de la nuque, rigidité musculaire, démarche parkinsonienne, et réflexe palpébral anormal), akathisie (akathisie, agitation, hyperkinésie, et syndrome des jambes sans repos), tremblement, dyskinésie (dyskinésie, contraction musculaire, choréathétose, athétose, et myoclonie), dystonie.
- Autres évènements indésirables rapportés avec Risperdal oral mais non rapportés avec Risperdalconsta LP par système organe :
-
- Investigations : augmentation de la température corporelle, augmentation du nombre des éosinophiles, diminution du nombre des globules blancs, diminution de l’hémoglobine, augmentation de la créatine phosphokinase sérique, diminution de la température corporelle.
- Infections et infestations : angine, cellulite, otite moyenne, infection oculaire, acarodermatite, infection des voies respiratoires, onychomycose, otite moyenne chronique.
- Affections hématologiques et du système lymphatique : granulocytopénie.
- Affections du système immunitaire : hypersensibilité au produit.
- Troubles du métabolisme et de la nutrition : anorexie, polydipsie.
- Affections psychiatriques : état confusionnel, léthargie, anorgasmie, émoussement de l’affect.
- Affections du système nerveux : absence de réponse aux stimuli, perte de conscience, syndrome malin des neuroleptiques, coma diabétique, accident cérébrovasculaire, diminution de l’état de conscience, ischémie cérébrale, trouble cérébrovasculaire, accident vasculaire ischémique transitoire, dysarthrie, trouble de l’attention, trouble de l’équilibre, trouble de l’élocution, coordination anormale, trouble de la motricité.
- Affections oculaires : hyperémie oculaire, écoulement oculaire, gonflement oculaire, sécheresse oculaire, larmoiement accru, photophobie, diminution de l’acuité visuelle, révulsion oculaire, glaucome.
- Affections de l’oreille et du labyrinthe : acouphènes.
- Troubles vasculaires : bouffées vasomotrices.
- Affections respiratoires, thoraciques et médiastinales : sifflement, pneumonie d’inhalation, congestion pulmonaire, troubles respiratoires, râles, épistaxis, obstruction des voies respiratoires, hyperventilation, dysphonie.
- Affections gastro-intestinales : dysphagie, incontinence fécale, fécalome, gonflement des lèvres, chéilite.
- Affections de la peau et du tissu sous-cutané : lésion cutanée, troubles cutanés, décoloration cutanée, dermatite séborrhéique, hyperkératose, pellicules, érythème.
- Affections musculo-squelettiques et systémiques : rhabdomyolyse, gonflement articulaire, posture anormale, raideur articulaire.
- Troubles du rein et des voies urinaires : énurésie, dysurie, pollakiurie.
- Affections des organes de reproduction et du sein : troubles de l’éjaculation, écoulement vaginal, troubles menstruels.
- Troubles généraux et anomalies au site d’administration : oedème généralisé, oedème de la face, altération de la marche, soif, frissons, froideur périphérique, syndrome de sevrage.
- Investigations : augmentation de la température corporelle, augmentation du nombre des éosinophiles, diminution du nombre des globules blancs, diminution de l’hémoglobine, augmentation de la créatine phosphokinase sérique, diminution de la température corporelle.
- Effets de classe : comme pour d’autres antipsychotiques, de très rares cas d’allongement du QT ont été rapportés après commercialisation avec la rispéridone. Les autres effets cardiaques de classe rapportés avec les antipsychotiques qui prolongent l’intervalle QT incluent arythmie ventriculaire, fibrillation ventriculaire, tachycardie ventriculaire, mort subite, arrêt cardiaque et torsades de pointes.
- Prise de poids : dans une étude de 12 semaines, en double aveugle, contrôlée versus placebo, 9 % des patients traités par Risperdalconsta LP, comparé à 6 % de patients traités par le placebo, ont présenté une prise de poids >= 7 % en fin d’étude. Dans une étude d’un an en ouvert avec Risperdalconsta LP, les modifications de poids chez des patients individuels ont été généralement de ± 7 % par rapport à l’état initial, 25 % ont présenté une prise de poids >= 7 %.
SURDOSAGE |
- Symptômes :
- En général, les signes et symptômes rapportés sont ceux résultant d’une exacerbation des effets pharmacologiques connus de la rispéridone. Ils incluent somnolence et sédation, tachycardie et hypotension, et symptômes extrapyramidaux. Au cours de surdosages, un allongement de l’intervalle QT et des convulsions ont été rapportés. Des torsades de pointes ont été rapportées dans le cadre de surdosage associant Risperdal oral et la paroxétine.
- En cas de surdosage aigu, l’implication possible de plusieurs médicaments doit être prise en compte.
- Traitement :
- Établir et maintenir l’accès aux voies aériennes supérieures et assurer une oxygénation et une ventilation adéquates. La surveillance cardiovasculaire doit commencer immédiatement et doit inclure un suivi électrocardiographique continu afin de détecter d’éventuelles arythmies.
- Il n’existe pas d’antidote spécifique à Risperdal. Des mesures appropriées de maintien des fonctions vitales doivent donc être mises en oeuvre. L’hypotension et le collapsus circulatoire doivent être traités par des mesures appropriées telles que l’administration de solutés de remplissage et/ou d’agents sympathomimétiques. En cas d’apparition de symptômes extrapyramidaux sévères, un médicament anticholinergique doit être administré. Une supervision et un suivi médical rapprochés doivent être poursuivis jusqu’au rétablissement du patient.
PHARMACODYNAMIE |
Classe pharmacothérapeutique : autres antipsychotiques (code ATC : N05AX08).
- Mécanisme d’action :
- La rispéridone est un antagoniste monoaminergique sélectif possédant des propriétés uniques. Elle a une forte affinité pour les récepteurs sérotoninergiques 5-HT2 et dopaminergiques D2. La rispéridone se lie également aux récepteurs alpha1-adrénergiques et, à un moindre degré, aux récepteurs histaminergiques H1 et alpha2– adrénergiques. La rispéridone n’a pas d’affinité pour les récepteurs cholinergiques. Bien que la rispéridone soit un puissant antagoniste D2, qui est considéré comme responsable de l’effet bénéfique sur les symptômes positifs de la schizophrénie, elle diminue moins la motricité et entraîne moins de catalepsie que les antipsychotiques conventionnels. L’équilibre entre l’antagonisme sérotoninergique et l’antagonisme dopaminergique peut diminuer la susceptibilité aux effets extrapyramidaux et élargit l’effet thérapeutique aux symptômes négatifs et affectifs de la schizophrénie.
- Efficacité clinique :
- L’efficacité de Risperdalconsta LP (25 mg et 50 mg) dans le traitement des troubles psychotiques (schizophrénie/troubles schizo-affectifs) a été établie dans une étude de 12 semaines, contrôlée versus placebo, chez des patients adultes psychotiques hospitalisés et ambulatoires ayant un diagnostic de schizophrénie répondant aux critères DSM-IV.
- Dans une étude contrôlée de 12 semaines réalisée chez des patients stabilisés présentant une schizophrénie, l’efficacité de Risperdalconsta LP a été similaire à celle de la rispéridone orale.
- L’efficacité et la tolérance à long terme (50 semaines) de Risperdalconsta LP ont également été étudiées dans une étude en ouvert chez des patients psychotiques stables hospitalisés et ambulatoires répondant aux critères DSM-IV de la schizophrénie ou de troubles schizo-affectifs. L’efficacité de Risperdalconsta LP a été maintenue dans le temps (Figure 1).
-
Figure 1 : Score moyen total PANSS (Positive and Negative Syndrome Scale) en fonction du temps (LOCF) chez des patients schizophrènes. 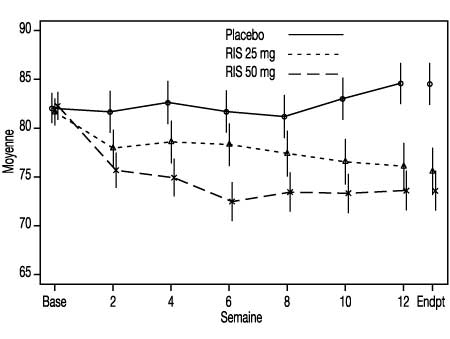
PHARMACOCINÉTIQUE |
- Absorption :
- L’absorption de la rispéridone est complète après administration de Risperdalconsta LP.
- Après injection IM unique de Risperdalconsta LP, le profil plasmatique de libération correspond à une faible libération initiale de rispéridone (< 1 % de la dose), suivie d’une période de latence de 3 semaines. La phase de libération principale débute à partir de la 3e semaine, se poursuit pendant 4 à 6 semaines, et se termine à la 7e semaine. Une couverture antipsychotique orale doit donc être donnée pendant les 3 premières semaines du traitement par Risperdalconsta LP (cf Posologie et Mode d’administration).
- L’association du profil de libération et du schéma posologique (injection intramusculaire toutes les 2 semaines) aboutit au maintien prolongé de concentrations thérapeutiques plasmatiques. Les concentrations plasmatiques sont stables pendant 4 à 6 semaines après la dernière injection de Risperdalconsta LP.
- Après injections intramusculaires répétées de 25 mg ou 50 mg de Risperdalconsta LP toutes les 2 semaines, les concentrations médianes de la fraction active à la vallée et au pic fluctuent entre 9,9-19,2 ng/ml et 17,9-45,5 ng/ml respectivement. Aucune accumulation de rispéridone n’a été observée au cours d’une administration prolongée (12 mois) chez des patients recevant des injections de 25-50 mg toutes les deux semaines.
- Les études décrites ci-dessus ont été réalisées par injection dans le muscle fessier. Les injections intramusculaires dans le muscle fessier ou deltoïde sont bioéquivalentes à doses identiques et, de ce fait, sont interchangeables.
- Distribution :
- La rispéridone se distribue rapidement. Le volume de distribution est de 1-2 l/kg. Dans le plasma, la rispéridone est liée à l’albumine et à l’alpha1-glycoprotéine acide. La liaison aux protéines plasmatiques de la rispéridone est de 90 % ; celle du métabolite actif la 9-hydroxy-rispéridone est de 77 %.
- Biotransformation et élimination :
- La rispéridone est métabolisée par le CYP2D6 en 9-hydroxy-rispéridone dont l’activité pharmacologique est similaire à celle de la rispéridone. L’ensemble rispéridone plus 9-hydroxy-rispéridone constitue la fraction antipsychotique active. Le CYP2D6 est soumis au polymorphisme génétique. Les métaboliseurs rapides du CYP2D6 métabolisent rapidement la rispéridone en 9-hydroxy-rispéridone, alors que les métaboliseurs lents du CYP2D6 la métabolisent beaucoup plus lentement. Bien que les métaboliseurs rapides aient des concentrations plus faibles en rispéridone et plus élevées en 9-hydroxy-rispéridone que les métaboliseurs lents, la pharmacocinétique de l’ensemble rispéridone et 9-hydroxy-rispéridone (c’est-à-dire de la fraction antipsychotique active), après administrations uniques et réitérées, est similaire chez les métaboliseurs rapides et lents du CYP2D6.
- Une autre voie métabolique de la rispéridone est la N-déalkylation. Les études in vitro sur microsomes de foies humains ont montré que la rispéridone à des concentrations plasmatiques cliniquement significatives n’inhibe pas de manière substantielle le métabolisme des médicaments métabolisés par les isoenzymes du cytochrome P450, incluant le CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4, et CYP3A5.
- Une semaine après administration orale de rispéridone, 70 % de la dose est excrétée dans les urines et 14 % dans les fèces. Dans les urines, la rispéridone plus la 9-hydroxy-rispéridone représentent 35-45 % de la dose administrée par voie orale. Le reste correspond à des métabolites inactifs. La phase d’élimination est terminée 7 à 8 semaines après la dernière injection de Risperdalconsta LP.
- Linéarité :
- La pharmacocinétique de la rispéridone après administration unique de Risperdalconsta LP est linéaire dans la gamme 25 mg-75 mg. La pharmacocinétique de la rispéridone est également linéaire dans l’intervalle de doses comprises entre 25-50 mg injectées toutes les 2 semaines.
- Sujet âgé, insuffisant hépatique et insuffisant rénal :
- Une étude à dose unique a montré des concentrations plasmatiques de la fraction antipsychotique active d’environ 43 % plus élevées, une demi-vie 38 % plus longue et une diminution de 30 % de la clairance de la fraction antipsychotique active chez le sujet âgé. Des concentrations plus élevées de la fraction antipsychotique active et une diminution de la clairance de la fraction antipsychotique active d’environ 60 % ont été observées chez le patient insuffisant rénal. Les concentrations plasmatiques de rispéridone sont normales chez les patients insuffisants hépatiques, mais la fraction libre moyenne de la rispéridone dans le plasma est augmentée d’environ 35 %.
- Relation entre pharmacocinétique et pharmacodynamie :
- Il n’a pas été observé de relation entre les concentrations plasmatiques de la fraction antipsychotique active et les variations des scores de la PANSS totale (Positive and Negative Syndrome Scale) et de l’ESRS total (Extrapyramidal Symptom Rating Scale) au cours des visites d’évaluation dans aucune des études de phase III au cours desquelles l’efficacité et la tolérance ont été évaluées.
- Sexe, origine ethnique et tabagisme :
- Une analyse de pharmacocinétique de population a révélé l’absence d’effet apparent du sexe, de l’origine ethnique ou du tabagisme sur la pharmacocinétique de la fraction antipsychotique active.
SÉCURITE PRÉCLINIQUE |
De façon comparable aux études de toxicité (sub)chronique réalisées avec la rispéridone orale chez le rat et le chien, les effets principaux du traitement par Risperdalconsta LP (jusqu’à 12 mois par administration intramusculaire) sont une stimulation de la glande mammaire médiée par la prolactine, des modifications du tractus génital mâle et femelle, et des effets sur le système nerveux central, dus à l’activité pharmacodynamique de la rispéridone.
La rispéridone n’est pas tératogène chez le rat et le lapin. Au cours des études de reproduction chez le rat avec la rispéridone, des effets indésirables ont été observés sur le comportement lors de l’accouplement des parents et sur le poids de naissance et la survie de la progéniture. Chez le rat, une exposition intra-utérine à la rispéridone a été associée à des déficits cognitifs à l’âge adulte. D’autres antagonistes dopaminergiques, lorsqu’ils ont été administrés à des animaux gravides, ont entraîné des effets délétères sur les capacités de développement moteur et d’apprentissage de la progéniture.
L’administration de Risperdalconsta LP pendant 12 à 24 mois à des rats mâles et femelles a produit une ostéodystrophie à la dose de 40 mg/kg/2 semaines. Chez le rat, l’effet dose pour l’ostéodystrophie correspondait sur une base exprimée en mg/m2 à 8 fois la dose maximale recommandée chez l’homme et était associée à 2 fois l’exposition plasmatique maximale attendue à la dose maximale recommandée chez l’homme. Aucune ostéodystrophie n’a été observée chez le chien traité pendant 12 mois par Risperdalconsta LP à des doses allant jusqu’à 20 mg/kg/2 semaines. Cette dose correspond à une exposition plasmatique allant jusqu’à 14 fois la dose maximale recommandée chez l’homme.
Aucun potentiel génotoxique n’a été mis en évidence.
Comme attendu pour un puissant antagoniste dopaminergique D2, au cours des études de cancérogenèse orale chez le rat et la souris, une augmentation des adénomes hypophysaires (souris), des adénomes du pancréas endocrine (rat), et des adénomes des glandes mammaires (chez les deux espèces) ont été observés.
Au cours d’une étude de cancérogenèse avec Risperdalconsta LP chez le rat Wistar (Hannover) [doses de 5 et 40 mg/kg/2 semaines], une augmentation de l’incidence des tumeurs du pancréas endocrine, de l’hypophyse et de la surrénale a été observée à la dose de 40 mg/kg, tandis que des tumeurs de la glande mammaire ont été observées aux doses de 5 et 40 mg/kg. Ces tumeurs observées après administration orale et intramusculaire peuvent être dues à une prolongation de l’antagonisme D2 et une hyperprolactinémie.
Les études sur culture de tissus suggèrent que la croissance cellulaire pourrait être stimulée par la prolactine dans les tumeurs du sein chez l’homme. Une hypercalcémie, suspectée d’avoir pu contribuer à l’augmentation de l’incidence des adénomes de la surrénale chez des rats traités par Risperdalconsta LP, a été retrouvée dans les deux groupes de doses. Il n’existe pas de données suggérant que l’hypercalcémie soit susceptible d’entraîner la survenue de phéochromocytomes chez l’homme.
Des adénomes des tubules rénaux ont également été observés chez des rats mâles traités par Risperdalconsta LP à la dose de 40 mg/kg/2 semaines. Aucune tumeur rénale n’a été observée dans le groupe à faible dose, le groupe NaCl 0,9 %, ou le groupe contrôle avec le solvant des microsphères. Le mécanisme sous-jacent à la survenue des tumeurs rénales chez les rats Wistar (Hannover) traités par Risperdalconsta LP est inconnu. Une augmentation de l’incidence des tumeurs rénales liées au traitement n’a pas été retrouvée dans les études de cancérogenèse après administration orale de rispéridone chez le rat Wistar (Wiga) ou la souris Swiss. Les études réalisées pour évaluer les différences intersouches en termes de profil tumoral suggèrent que la souche Wistar (Hannover) utilisée dans l’étude de cancérogenèse diffère de façon substantielle de la souche Wistar (Wiga) utilisée dans l’étude de cancérogenèse par voie orale en terme de modifications rénales non néoplasiques liées à l’âge, d’augmentations de la prolactinémie, et de modifications rénales liées à la rispéridone. Il n’existe pas de données suggérant la survenue de modifications rénales chez le chien traité au long terme par Risperdalconsta LP.
La signification de l’ostéodystrophie, des tumeurs médiées par la prolactine et des modifications rénales présumées spécifiques d’une souche de rat est inconnue en terme de risque pour l’homme.
Des phénomènes d’irritation locale au site d’injection ont été observés chez le chien et le rat après administration de fortes doses de Risperdalconsta LP. Dans une étude de cancérogenèse de 24 mois chez le rat, aucune augmentation de l’incidence des tumeurs au site d’injection n’a été observée dans les groupes véhicule ou traitement actif.
In vitro et in vivo, les modèles animaux montrent que des doses élevées de rispéridone peuvent entraîner un allongement de l’intervalle QT, qui a été associé à une augmentation théorique du risque de survenue de torsades de pointe chez les patients.
INCOMPATIBILITÉS |
Risperdalconsta LP ne doit pas être mélangé ou dilué avec d’autres médicaments ou solutions que le solvant pour administration fourni avec Risperdalconsta LP.
MODALITÉS DE CONSERVATION |
- Durée de conservation :
- 3 ans.
A conserver entre + 2 °C et + 8 °C (au réfrigérateur), dans l’emballage extérieur, à l’abri de la lumière.
Si la conservation au réfrigérateur n’est pas possible, Risperdalconsta LP peut être conservé avant administration à une température ne dépassant pas 25 °C pendant une durée maximale de 7 jours. Ne jamais exposer Risperdalconsta LP à une température supérieure à 25 °C.
- Après reconstitution :
- La stabilité physicochimique a été démontrée pendant 24 heures à + 25 °C. D’un point de vue microbiologique, le produit doit être administré immédiatement. S’il n’est pas utilisé immédiatement, les durées et conditions de conservation après reconstitution et avant utilisation sont de la responsabilité de l’utilisateur et ne devraient normalement pas dépasser 24 heures entre + 2 °C et + 8 °C, sauf si la reconstitution a été réalisée dans des conditions aseptiques contrôlées et validées.
MODALITÉS MANIPULATION/ÉLIMINATION |
Les microsphères à libération prolongée de Risperdalconsta LP contenues dans le flacon doivent être remises en suspension uniquement avec le solvant contenu dans la seringue fournie dans le conditionnement et doivent être administrées uniquement avec l’aiguille sécurisée Needle-Pro appropriée fournie dans le conditionnement pour l’administration dans le muscle fessier (aiguille de 2 pouces [50 mm]) ou deltoïde (aiguille de 1 pouce [25 mm]). Ne substituer aucun élément du conditionnement. Afin de s’assurer que la dose prévue de rispéridone soit délivrée, la totalité du contenu du flacon doit être administrée. L’administration partielle du contenu du flacon peut ne pas délivrer la quantité attendue de rispéridone.
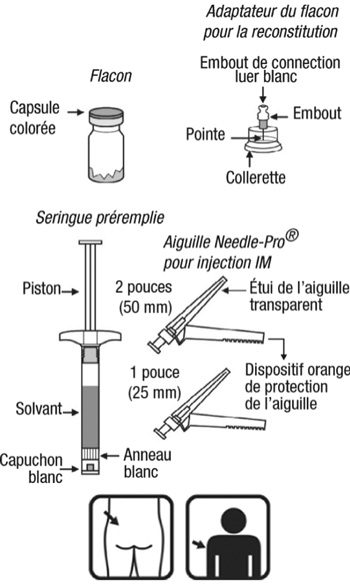 |
Sortir le conditionnement de Risperdalconsta LP du réfrigérateur afin de l’amener à température ambiante avant reconstitution.
Contenu du conditionnement extérieur :- un flacon contenant les microsphères à libération prolongée de Risperdalconsta LP ;
- un adaptateur pour flacon Alaris Smartsite pour la reconstitution du produit ;
- une seringue préremplie contenant le solvant de Risperdalconsta LP ;
- deux aiguilles pour injection intramusculaire (une aiguille sécurisée 21G UTW de 1 pouce [0,8 mm × 25 mm] avec dispositif Needle Pro de protection de l’aiguille pour administration dans le muscle deltoïde et une aiguille sécurisée 20G TW de 2 pouces [0,9 mm × 50 mm] avec dispositif Needle Pro de protection de l’aiguille pour administration dans le muscle fessier).
- Retirer la capsule colorée en plastique du flacon.
- Ouvrir l’emballage de l’adaptateur et sortir l’adaptateur du flacon en le tenant par l’embout Luer blanc.
- Ne toucher à aucun moment la pointe d’aiguille de l’adaptateur.
- Placer le flacon sur une surface dure. D’un mouvement vif vers le bas, pousser l’extrémité de la pointe de l’adaptateur à travers le centre du bouchon en caoutchouc du flacon jusqu’à entendre le déclic indiquant que l’adaptateur est bien fixé sur le haut du flacon.
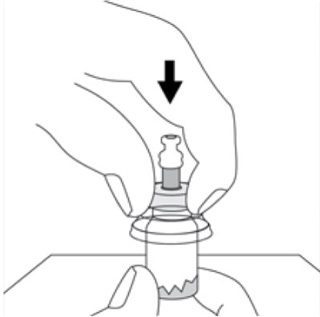
- Nettoyer l’embout de connexion à la seringue (rond bleu) de l’adaptateur pour flacon Smartsite avec un antiseptique approprié avant de fixer la seringue sur l’adaptateur.
- L’extrémité blanche de la seringue préremplie se compose de 2 parties : un anneau blanc et un capuchon blanc lisse. Pour ouvrir la seringue, tenir la seringue par l’anneau blanc et casser net le capuchon blanc lisse (ne pas dévisser le capuchon blanc). Retirer le capuchon blanc en même temps que le capuchon intérieur en caoutchouc.
Pour toutes les étapes d’assemblage, tenir la seringue uniquement par l’anneau blanc situé à l’extrémité de la seringue. Faire attention à ne pas trop serrer les composants au moment de l’assemblage. Un serrage excessif peut entraîner la désolidarisation de certains éléments de la seringue.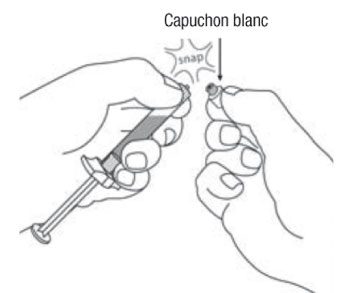
- En la tenant par l’anneau blanc, introduire et pousser l’extrémité de la seringue dans le rond bleu de l’orifice de connexion de l’adaptateur et visser dans le sens des aiguilles d’une montre pour sécuriser la fixation de la seringue à l’adaptateur (éviter de serrer trop fortement).
- Tenir la collerette de l’adaptateur pendant la fixation pour éviter qu’il ne tourne.
- Maintenir la seringue et l’adaptateur alignés.
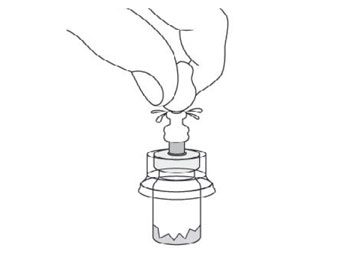
- Injecter l’intégralité du contenu de la seringue contenant le solvant dans le flacon.
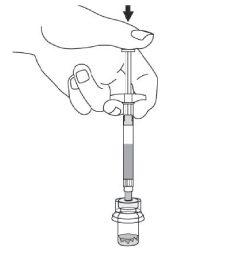
- Agiter vigoureusement le flacon tout en maintenant le piston enfoncé avec le pouce pendant au moins 10 secondes pour s’assurer d’obtenir une suspension homogène.
- Lorsqu’elle a été agitée correctement, la suspension apparaît uniforme, épaisse et de couleur laiteuse. Les microsphères seront toujours visibles dans le liquide, mais il ne devra rester aucune microsphère sèche.
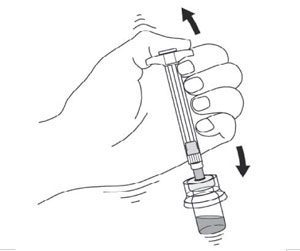
Ne pas conserver le flacon après reconstitution, car la suspension pourrait sédimenter. -
- Retourner complètement le flacon et prélever lentement dans la seringue l’intégralité du contenu de la suspension contenue dans le flacon.
- Découper la partie détachable de l’étiquette du flacon suivant les pointillés et l’appliquer sur la seringue dans un but d’identification.
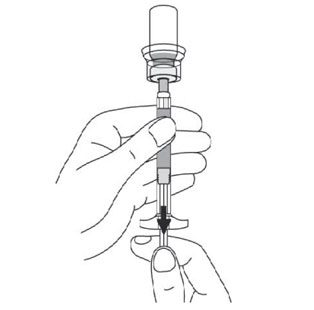
- Dévisser la seringue de l’adaptateur en la tenant par l’anneau blanc. Jeter le flacon et l’adaptateur dans un endroit prévu à cet effet.
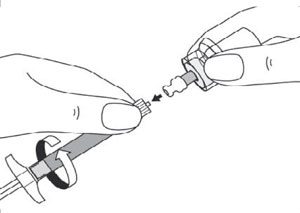
- Ouvrir le sachet contenant les aiguilles et sélectionner l’aiguille adéquate. Ne pas toucher l’embout de l’aiguille, manipuler l’aiguille uniquement par son capuchon transparent :
- pour une injection dans le muscle fessier, sélectionner l’aiguille 20G TW de 2 pouces (0,9 mm × 50 mm ; aiguille la plus longue avec embout jaune) ;
- pour une injection dans le muscle deltoïde, sélectionner l’aiguille 21G UTW de 1 pouce (0,8 mm × 25 mm ; aiguille la plus courte avec embout vert).
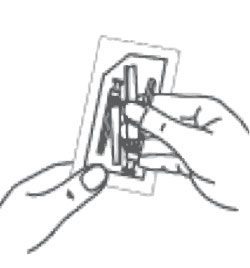
- pour une injection dans le muscle fessier, sélectionner l’aiguille 20G TW de 2 pouces (0,9 mm × 50 mm ; aiguille la plus longue avec embout jaune) ;
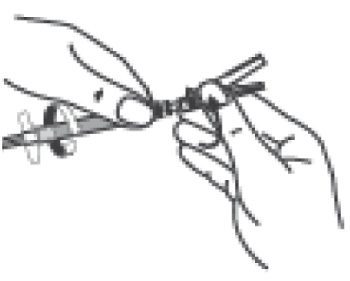
- En tenant la seringue par l’anneau blanc, visser l’embout Luer du dispositif de sécurité Needle-Pro orange sur la seringue en tournant dans le sens des aiguilles d’une montre.
- En tenant toujours la seringue par l’anneau blanc, saisir le capuchon protecteur de l’aiguille et positionner l’aiguille fermement sur le dispositif de sécurité Needle-Pro orange en appuyant tout en tournant dans le sens des aiguilles d’une montre.
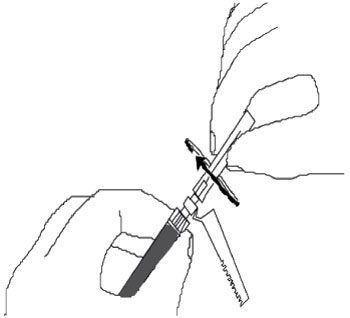
Une remise en suspension de Risperdalconsta LP est nécessaire avant administration du produit, car le produit sédimente au cours du temps après reconstitution. Agiter vigoureusement les microsphères dans la seringue afin de remettre les microsphères en suspension. -
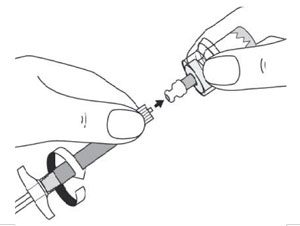
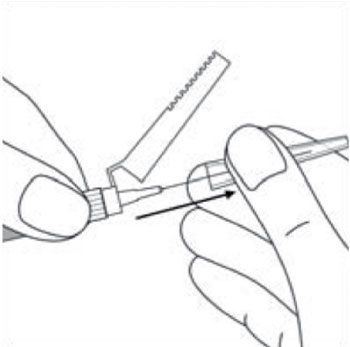
- En tenant la seringue par l’anneau blanc, retirer le capuchon protecteur transparent de l’aiguille en tirant dans l’axe de l’aiguille. Ne pas tourner le capuchon protecteur, car cela risque de désolidariser les embouts luer.
- Tapoter doucement la seringue afin de faire remonter les éventuelles bulles d’air.
- Faire sortir l’air de la seringue en enfonçant le piston, l’aiguille étant dirigée vers le haut. Injecter la totalité du contenu de la seringue dans le muscle fessier ou deltoïde du patient. L’injection dans le muscle fessier doit se faire dans le quadrant supéro-externe de la fesse.
- Ne pas administrer par voie intraveineuse.
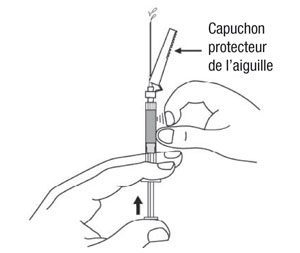
Attention :
Afin d’éviter toute blessure avec une aiguille contaminée :- Ne pas utiliser la main libre pour placer le dispositif de sécurité Needle-Pro sur l’aiguille.
- Ne pas enlever intentionnellement le dispositif de sécurité Needle-Pro.
- Ne pas essayer de redresser l’aiguille ou de mettre en place le dispositif de sécurité Needle-Pro si l’aiguille est courbée ou endommagée.
- Ne pas manipuler brutalement le dispositif de sécurité Needle-Pro, car l’aiguille pourrait l’endommager.
- Ne pas utiliser la main libre pour placer le dispositif de sécurité Needle-Pro sur l’aiguille.
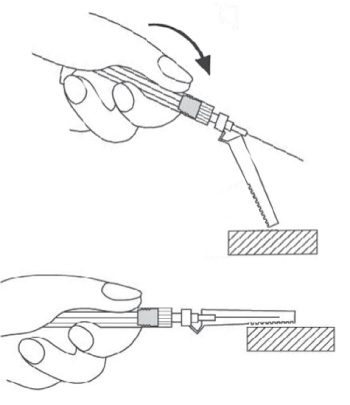
- Une fois l’injection réalisée, placer le dispositif de sécurité Needle-Pro orange sur l’aiguille d’une seule main. Appuyer délicatement le dispositif de sécurité Needle-Pro orange d’une main contre le dessus d’une table ou une autre surface plane et dure. En appuyant sur le dispositif de sécurité Needle-Pro orange, l’aiguille s’insérera fermement dans le dispositif de sécurité Needle-Pro orange.
- Vérifier visuellement que l’aiguille est complètement insérée dans le dispositif de sécurité Needle-Pro orange avant élimination. Jeter l’aiguille dans un endroit prévu à cet effet. Jeter également l’autre aiguille (inutilisée) fournie dans le conditionnement.
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM | 3400936249134 (2003, RCP rév 04.03.2011) 25 mg/2 ml. |
| 3400936249363 (2003, RCP rév 21.02.2011) 37,5 mg/2 ml. | |
| 3400936249424 (2003, RCP rév 04.03.2011) 50 mg/2 ml. |
| Prix : | 114.64 euros (25 mg/2 ml). |
| 147.46 euros (37,5 mg/2 ml). | |
| 180.30 euros (50 mg/2 ml). | |
| Remb Séc soc à 65 %. Collect. | |
JANSSEN-CILAG
1, rue Camille-Desmoulins. TSA 91003
92787 Issy-les-Moulineaux cdx 9
Info médic et Pharmacovigilance :
Tél (n° Vert) : 08 00 25 50 75 E-mail : medisource@its.jnj.com
Liste Des Sections Les Plus Importantes :
- pathologies
- Medicaments
- Medicaments injectables
- Traitement D’Urgence
- Guide Infirmier Des Examens De Laboratoire
- Infirmiers En Urgences
- Fiche Technique Medical
- Techniques De Manipulations En Radiologie Medicale
- Bibliotheque_medicale



