vaccin rotavirus (vivant, oral)
FORMES et PRÉSENTATIONS |
COMPOSITION |
| p 1 dose de 2 ml | ||
| Type de rotavirus* G1 | >= 2,2 × 106 UI(1)(2) | |
| Type de rotavirus* G2 | >= 2,8 × 106 UI(1)(2) | |
| Type de rotavirus* G3 | >= 2,2 × 106 UI(1)(2) | |
| Type de rotavirus* G4 | >= 2,0 × 106 UI(1)(2) | |
| Type de rotavirus* P1A[8] | >= 2,3 × 106 UI(1)(2) | |
Teneur en saccharose : 1080 mg/dose (cf Mises en garde et Précautions d’emploi).
* Rotavirus réassortants humain-bovin (vivant), produits sur cellules Vero.
(1) Unités infectieuses.
(2) Limite inférieure de l’intervalle de confiance (p = 0,95).
INDICATIONS |
POSOLOGIE ET MODE D’ADMINISTRATION |
- De la naissance à 6 semaines :
- RotaTeq n’est pas indiqué dans cette tranche d’âge.
- La tolérance et l’efficacité de RotaTeq chez des sujets âgés de moins de 6 semaines n’ont pas été évaluées.
- De 6 à 26 semaines :
- 3 doses de RotaTeq doivent être administrées.
- La première dose peut être administrée à partir de l’âge de 6 semaines et au plus tard à l’âge de 12 semaines.
- RotaTeq peut être administré à des nourrissons nés prématurés, à condition que la durée de la grossesse soit de 25 semaines au moins. Ces nourrissons doivent recevoir la première dose de RotaTeq au moins 6 semaines après leur naissance. Cf Mises en garde et Précautions d’emploi, Pharmacodynamie.
- L’intervalle entre chaque dose doit être d’au moins 4 semaines.
- Il est préférable que les 3 doses soient administrées avant l’âge de 20-22 semaines.
- Les 3 doses doivent être administrées avant l’âge de 26 semaines.
- Il n’existe pas de données sur l’interchangeabilité de RotaTeq avec un autre vaccin rotavirus. Il est recommandé que les enfants qui ont reçu une première dose de RotaTeq continuent de recevoir ce même vaccin pour les doses suivantes.
- Si une dose incomplète a été avalée de façon certaine ou fortement probable, (par exemple si le nourrisson recrache ou régurgite le vaccin), une dose unique de remplacement peut être donnée lors de la même consultation, cependant cette pratique n’a pas été étudiée dans des essais cliniques. Si l’incident se reproduit, une dose additionnelle ne doit pas être donnée.
- Il n’est pas recommandé d’administrer de dose supplémentaire après avoir terminé le schéma en 3 doses (cf Mises en garde et Précautions d’emploi, Pharmacodynamie, pour les informations disponibles sur la durée de la protection).
- De 26 semaines à 18 ans :
- RotaTeq n’est pas indiqué dans cette tranche d’âge.
Mode d’administration :
Pour administration orale uniquement.
RotaTeq ne doit jamais être injecté.
RotaTeq peut être administré sans précaution particulière vis-à-vis de la nourriture, des liquides ou du lait maternel.
Cf Modalités de manipulation et d’élimination pour les instructions d’administration.
CONTRE-INDICATIONS |
- Hypersensibilité aux substances actives ou à l’un des excipients.
- Hypersensibilité suite à une précédente administration de vaccin rotavirus.
- Antécédent d’invagination intestinale.
- Nourrissons ayant une malformation congénitale de l’appareil gastro-intestinal pouvant prédisposer à une invagination intestinale.
- Nourrissons ayant une immunodépression connue ou suspectée. Une infection asymptomatique par le VIH ne devrait pas affecter la tolérance ou l’efficacité de RotaTeq. Cependant, en l’absence de données suffisantes, l’administration de RotaTeq à des nourrissons ayant une infection asymptomatique par le VIH n’est pas recommandée.
- L’administration de RotaTeq doit être différée chez les nourrissons ayant une maladie fébrile sévère aiguë grave. Une infection bénigne n’est pas une contre-indication à la vaccination.
- L’administration de RotaTeq doit être différée chez les sujets présentant une diarrhée aiguë ou des vomissements.
MISES EN GARDE et PRÉCAUTIONS D’EMPLOI |
- Il n’existe pas de données de tolérance ou d’efficacité issues des essais cliniques sur l’administration de RotaTeq à des nourrissons immunodéprimés, des nourrissons infectés par le VIH ou des nourrissons qui ont reçu une transfusion sanguine ou des immunoglobulines dans les 42 jours précédant l’administration de RotaTeq.
- Des cas de gastro-entérites associés au virus vaccinal ont été rapportés après la mise sur le marché chez des nourrissons présentant un déficit immunitaire combiné sévère (DICS).
- Au cours des études cliniques, RotaTeq a été éliminé dans les selles de 8,9 % des nourrissons vaccinés, presque exclusivement dans la semaine suivant la première dose et chez un seul nourrisson (0,3 %) après la troisième dose.
- Le pic d’élimination est observé dans les 7 jours suivant l’administration de la dose. La transmission de souches virales vaccinales à des sujets contacts non vaccinés a été observée après mise sur le marché. RotaTeq devra être administré avec précaution chez les sujets en contact étroit avec des patients immunodéprimés (sujets présentant une pathologie maligne ou tout type d’immunodépression, sujets recevant une thérapie immunosuppressive). De plus, les personnes s’occupant d’enfants récemment vaccinés doivent soigneusement observer des règles d’hygiène, en particulier lors de contacts avec des selles.
- Dans une étude clinique, RotaTeq a été administré à environ 1000 nourrissons prématurés, nés après une grossesse de 25 à 36 semaines. La première dose a été administrée 6 semaines après la naissance. La tolérance et l’efficacité de RotaTeq ont été comparables entre ce sous-groupe de nourrissons et la population de nourrissons nés à terme. Toutefois, parmi ces environ 1000 enfants, 19 sont nés après une grossesse comprise entre 25 et 28 semaines, 55 sont nés après une grossesse comprise entre 29 et 31 semaines, les autres nourrissons étant nés après une grossesse comprise entre 32 et 36 semaines. Cf Posologie et Mode d’administration, Pharmacodynamie.
- Il n’a pas été observé d’augmentation du risque d’invagination intestinale dans les études cliniques après l’administration de RotaTeq comparativement au placebo. Cependant, une faible augmentation du risque d’invagination intestinale dans la période des 31 jours, principalement dans les 7 jours suivant l’administration de la première dose de RotaTeq, ne peut pas être exclue. Ainsi, par précaution, les professionnels de santé doivent surveiller tout symptôme évoquant une invagination intestinale (douleur abdominale sévère, vomissements persistants, selles sanglantes, ballonnement abdominal et/ou forte fièvre). Il doit être recommandé aux parents ou tuteurs de signaler immédiatement de tels symptômes.
- La tolérance et l’efficacité n’ont pas été étudiées chez les nourrissons présentant une maladie évolutive du système gastro-intestinal (incluant une diarrhée chronique) ou un retard de croissance. L’administration de RotaTeq doit être envisagée avec précaution chez ces nourrissons quand, selon l’avis du médecin, ne pas vacciner entraîne un plus grand risque.
- Le niveau de protection conféré par RotaTeq est basé sur l’administration d’un schéma de vaccination en 3 doses. Comme avec d’autres vaccins, la vaccination avec RotaTeq peut ne pas protéger complètement tous les sujets. RotaTeq ne protège pas contre les gastro-entérites dues à des agents pathogènes autres que le rotavirus.
- Des essais cliniques d’efficacité contre les gastro-entérites à rotavirus ont été réalisés en Europe, aux États Unis, en Amérique latine et en Asie. Lors de ces essais, G1P[8] était le génotype de rotavirus qui a le plus communément circulé, tandis que les génotypes de rotavirus G2P[4], G3P[8], G4P[8] et G9P[8] étaient moins souvent identifiés. L’étendue de la protection que RotaTeq peut conférer contre d’autres génotypes de rotavirus et dans d’autres populations n’est pas connue.
- L’utilisation de RotaTeq en prophylaxie après exposition au rotavirus n’a pas été étudiée.
- RotaTeq contient du saccharose. Les patients qui présentent des problèmes héréditaires rares d’intolérance au fructose, une malabsorption du glucose-galactose ou une insuffisance en saccharase-isomaltase ne doivent pas recevoir ce vaccin (cf Composition).
- Le risque potentiel d’apnée avec nécessité de surveillance respiratoire pendant 48 à 72 h doit être soigneusement pris en compte lors de l’administration des doses de primovaccination chez les grands prématurés (nés à 28 semaines de grossesse ou moins) et particulièrement chez ceux ayant des antécédents d’immaturité respiratoire. En raison du bénéfice élevé de la vaccination chez ces nourrissons, l’administration ne doit pas être suspendue ou reportée.
INTERACTIONS |
La coadministration de RotaTeq avec des vaccins contenant un ou plusieurs des antigènes suivants à l’âge d’environ 2, 4 et 6 mois a démontré que les réponses immunitaires et les profils de tolérance des vaccins administrés n’étaient pas modifiés :
- vaccin diphtérique-tétanique-coquelucheux acellulaire (DTCa) ;
- vaccin conjugué Haemophilus influenzae type b (Hib) ;
- vaccin poliomyélitique inactivé (IPV) ;
- vaccin de l’hépatite B (HBV) ;
- vaccin pneumococcique conjugué (VPC).
FERTILITÉ/GROSSESSE/ALLAITEMENT |
EFFETS INDÉSIRABLES |
- Résumé du profil de tolérance :
- Les événements indésirables ont été étudiés dans un sous-groupe de nourrissons (n = 6130 recevant RotaTeq et 5560 recevant un placebo) issus de 3 études cliniques contrôlées contre placebo. Les événements indésirables apparus dans les 42 jours suivant la vaccination avec RotaTeq, avec ou sans administration concomitante d’autres vaccins pédiatriques, ont été évalués. Au total, 47 % des nourrissons recevant RotaTeq ont présenté un effet indésirable comparé à 45,8 % des nourrissons recevant le placebo. Les effets indésirables les plus communément rapportés, qui sont survenus plus fréquemment avec le vaccin qu’avec le placebo, étaient fièvre (20,9 %), diarrhée (17,6 %) et vomissement (10,1 %).
- Les effets indésirables graves ont été évalués chez tous les participants des 3 études cliniques (36 150 recevant RotaTeq et 35 536 recevant le placebo) jusqu’à 42 jours après chaque dose. Leur fréquence totale a été de 0,1 % pour les nourrissons recevant RotaTeq et 0,2 % pour les nourrissons recevant le placebo.
- Résumé tabulé des effets indésirables :
- Les effets indésirables le plus fréquemment rapportés dans le groupe des vaccinés sont listés ci-dessous, par système classe-organe et fréquence. Sur la base de données issues de 3 essais cliniques au cours desquels 6130 nourrissons ont reçu RotaTeq et 5560 ont reçu le placebo, les effets indésirables listés ci-dessous sont survenus chez les nourrissons ayant reçu RotaTeq avec une augmentation de l’incidence entre 0,2 % et 2,5 % par rapport aux nourrissons ayant reçu le placebo. Les événements indésirables identifiés lors de l’expérience après commercialisation (y compris les notifications spontanées) sont notés en italique.
- Les fréquences sont rapportées comme : très fréquent (>= 1/10), fréquent (>= 1/100, < 1/10), peu fréquent (>= 1/1000, < 1/100), rare (>= 1/10 000, < 1/1000), fréquence indéterminée (ne peut être estimée à partir des données disponibles).
-
Effets indésirables suivant l’administration de RotaTeq dans les essais cliniques et rapportés après commercialisation : Infections et infestations : Fréquent Infection respiratoire haute Peu fréquent Rhinopharyngite, otite moyenne Affections respiratoires, thoraciques et médiastinales : Rare Bronchospasme Affections gastro-intestinales : Très fréquent Diarrhées, vomissements Peu fréquent Rectorragie(1), douleur abdominale haute Rare Invagination intestinale(1)(2) Affections de la peau et du tissu sous-cutané : Peu fréquent Éruption Rare Urticaire(1) Troubles généraux et anomalies au site d’administration : Très fréquent Fièvre -
(1)
Cet effet indésirable a été identifié lors de la surveillance après commercialisation.
- La catégorie de fréquence a été estimée à partir des données des essais cliniques.
- La catégorie de fréquence a été estimée à partir des données des essais cliniques.
-
(2)
Cf Mises en garde et Précautions d’emploi.
- Description d’effets indésirables sélectionnés :
- 5 cas de la maladie de Kawasaki ont été rapportés sur 36 150 nourrissons ayant reçu le vaccin (< 0,1 %) et 1 cas sur 35 536 nourrissons ayant reçu le placebo (< 0,1 %) donnant un risque relatif (RR) de 4,9 (IC 95 % 0,6 ; 239,1), non statistiquement significatif.
- Aucun risque accru de maladie de Kawasaki n’a été observé chez les nourrissons ayant reçu RotaTeq lors d’une large étude observationnelle de surveillance de la tolérance après mise sur le marché (cf Pharmacodynamie).
-
- Invagination intestinale :
- Le risque de survenue d’invaginations intestinales chez les nourrissons a été évalué dans une étude contrôlée contre placebo. Dans la période combinée de 42 jours suivant l’administration de chaque dose, il y a eu 6 cas d’invagination intestinale chez les 34 837 nourrissons recevant RotaTeq comparé à 5 cas chez les 34 788 nourrissons recevant le placebo. L’intervalle de confiance à 95 % du risque relatif était de 0,4 à 6,4. Il n’y a eu aucun regroupement de cas parmi les nourrissons recevant RotaTeq à quelque moment ou pour quelque dose que ce soit.
- Aucun risque accru d’invagination intestinale n’a été observé chez les nourrissons ayant reçu RotaTeq lors d’une large étude observationnelle de surveillance de la tolérance après mise sur le marché (cf Pharmacodynamie).
- Autres populations particulières :
- Apnée chez les grands prématurés (nés à 28 semaines de grossesse ou moins) : cf Mises en garde et Précautions d’emploi.
- Des gastro-entérites avec élimination dans les selles de virus vaccinal chez des nourrissons présentant un déficit immunitaire combiné sévère (DICS) ont été rapportées après commercialisation.
SURDOSAGE |
PHARMACODYNAMIE |
Classe pharmacothérapeutique : vaccins viraux (code ATC : J07BH02).
- Efficacité :
- Dans les études cliniques, l’efficacité a été démontrée contre les gastro-entérites dues à des rotavirus de génotype G1P[8], G2P[4], G3P[8], G4P[8] et G9P[8].
- L’efficacité de RotaTeq a été évaluée de deux façons différentes dans une étude clinique contrôlée contre placebo (Rotavirus Efficacy and Safety Trial [REST]) :
- Dans un groupe de 5673 nourrissons vaccinés (2834 dans le groupe vaccin), l’efficacité a été mesurée comme une réduction de l’incidence des gastro-entérites à rotavirus (RV) dues aux génotypes inclus dans le vaccin (G1-G4) et apparaissant au moins 14 jours après la troisième dose de vaccin, pendant toute la première saison épidémique suivant la vaccination.
- Dans un groupe de 68 038 nourrissons vaccinés (34 035 dans le groupe vaccin), l’efficacité protectrice a été mesurée comme une réduction du taux des hospitalisations et des admissions en service d’urgence pour gastro-entérites à RV à partir de 14 jours après la troisième dose.
- Dans un groupe de 5673 nourrissons vaccinés (2834 dans le groupe vaccin), l’efficacité a été mesurée comme une réduction de l’incidence des gastro-entérites à rotavirus (RV) dues aux génotypes inclus dans le vaccin (G1-G4) et apparaissant au moins 14 jours après la troisième dose de vaccin, pendant toute la première saison épidémique suivant la vaccination.
- Les résultats de ces analyses sont présentés dans le tableau suivant :
-
Réduction de l’incidence des gastro-entérites à RV pendant toute une saison épidémique suivant la vaccination (RotaTeq n = 2834) % [IC 95 % ] Efficacité toutes sévérités confondues par génotypes de rotavirus Maladie grave*
(G1-G4)Tout type de gravité
(G1-G4)G1 G2 G3 G4 G9 98,0 %
[88,3 ; 100,0](1)74,0 %
[66,8 ; 79,9](1)74,9 %
[67,3 ; 80,9](1)63,4 %
[2,6 ; 88,2](1)82,7 %
[< 0 ; 99,6]48,1 %
[< 0 ; 91,6]65,4 %
[< 0 ; 99,3]Réduction des hospitalisations/admissions en service d’urgence pour gastro-entérites à RV jusqu’à 2 ans après la vaccination (RotaTeq n = 34 035) % [IC 95 %] G1-G4 G1 G2 G3 G4 G9 94,5 %
[91,2 ; 96,6](1)95,1 %
[91,6 ; 97,1](1)87,6 %
[< 0 ; 98,5]93,4 %
[49,4 ; 99,1](1)89,1 %
[52,0 ; 97,5](1)100 %
[69,6 ; 100](1) -
*
Gravité définie par un score > 16/24 utilisant une échelle, validée cliniquement, fondée sur l’intensité et la durée des symptômes (fièvre, vomissement, diarrhée et modifications du comportement).
-
(1)
Statistiquement significatif.
- La réduction de l’incidence des gastro-entérites à RV dues à G1-G4 lors de la deuxième saison de rotavirus après vaccination était de 88,0 % [IC 95 % : 49,4 ; 98,7] pour les maladies graves et de 62,6 % [IC 95 % : 44,3 ; 75,4] pour les maladies de quelque gravité que ce soit.
- L’efficacité observée contre les rotavirus G2P[4], G3P[8], G4P[8] et G9P[8] est fondée sur un moins grand nombre de cas que pour G1. L’efficacité observée contre G2P[4] est plus probablement attribuée au composant G2 du vaccin.
- Une extension de l’étude REST a été conduite en Finlande. Cette « Finnish Extension Study (FES) » comprenait un sous-groupe de 20 736 nourrissons qui avaient été inclus précédemment dans REST. Ces nourrissons ont été suivis jusqu’à 3 ans suivant la vaccination dans FES.
- Dans l’étude REST, 403 hospitalisations ou visites aux urgences (20 dans le groupe vaccin et 383 dans le groupe placebo) associées à des gastro-entérites à rotavirus de type G1-G4 et G9 dans la population per protocole ont été rapportées. Les données complémentaires de FES ont permis d’augmenter ce nombre de 136 hospitalisations ou visites aux urgences supplémentaires, dont 9 dans le groupe vaccin et 127 dans le groupe placebo. Au total, 31 % et 25 % des hospitalisations ou visites aux urgences des groupes respectifs proviennent de FES.
- Dans les données combinées de REST et de FES, la réduction jusqu’à 3 ans suivant la vaccination du taux des hospitalisations et des admissions en service d’urgence pour gastro-entérites à RV était de 94,4 % [IC 95 % : 91,6 ; 96,2] pour les génotypes G1-G4, 95,5 % [IC 95 % : 92,8 ; 97,2] pour le génotype G1, 81,9 % [IC 95 % : 16,1 ; 98,0] pour le génotype G2, 89,0 % [IC 95 % : 53,3 ; 98,7] pour le génotype G3, 83,4 % [IC 95 % : 51,2 ; 95,8] pour le génotype G4, et 94,2 % [IC 95 % : 62,2 ; 99,9] pour le génotype G9. Lors de la troisième année, il n’y a pas eu d’hospitalisations ou de visites aux urgences pour cause de gastro-entérite à RV dans le groupe vaccin (n = 3112) et un cas (non typable) dans le groupe placebo (n = 3126).
- Le schéma de vaccination en 3 doses de RotaTeq doit être administré dans sa totalité (cf Posologie et Mode d’administration) pour acquérir le niveau et la durée de protection contre les gastro-entérites à rotavirus qui ont été observé lors des études cliniques. Néanmoins, des analyses post hoc indiquent que RotaTeq permet d’acquérir un certain niveau de réduction du nombre de cas de gastro-entérites à rotavirus ayant une sévérité nécessitant une hospitalisation ou une admission en service d’urgence avant d’avoir reçu l’ensemble des 3 doses (environ 14 jours après l’administration de la première dose et au-delà).
- Efficacité chez les nourrissons prématurés :
- Dans REST, RotaTeq a été administré à environ 1000 nourrissons, nés après une grossesse de 25 à 36 semaines. L’efficacité était comparable entre ce sous-groupe de nourrissons et la population de nourrissons nés à terme.
- Étude observationnelle de surveillance de la tolérance après mise sur le marché :
- Dans une large étude observationnelle prospective après mise sur le marché, les risques d’invagination intestinale ou de maladie de Kawasaki ont été analysés chez 85 150 nourrissons ayant reçu une ou plusieurs doses de RotaTeq (17 433 personnes-années de suivi).
- Pendant la période de suivi de 0 à 30 jours après la vaccination, il n’y avait pas de différence statistiquement significative des taux d’invagination intestinale ou de maladie de Kawasaki par rapport aux taux attendus en l’absence de vaccination. De plus, il n’y avait pas d’augmentation statistiquement significative de ces événements indésirables pendant la période de suivi de 0 à 30 jours comparativement à un groupe contrôle de nourrissons ayant reçu DTCa, mais pas RotaTeq (n = 62 617, 12 339 personnes-années de suivi). Pour les invaginations intestinales, il y avait 6 cas confirmés chez les nourrissons vaccinés avec RotaTeq et 5 cas chez les nourrissons du groupe contrôle vaccinés avec DTCa (risque relatif = 0,8 ; 95 % CI : 0,22-3,52). Pour la maladie de Kawasaki, il y avait un cas confirmé identifié chez les nourrissons vaccinés avec RotaTeq et un cas confirmé chez ceux du groupe contrôle vaccinés avec DTCa (risque relatif = 0,7 ; 95 % CI : 0,01-55,56). Aucune préoccupation particulière de tolérance n’a été identifiée dans les analyses de la tolérance générale.
- Données d’efficacité sur le terrain :
- Dans une étude observationnelle après mise sur le marché aux États-Unis, l’efficacité sur le terrain de RotaTeq dans la prévention des hospitalisations, des admissions dans les services d’urgence et des consultations médicales ambulatoires pour gastro-entérites à RV a été évaluée en utilisant une importante base de données nationale. Dans cette étude, l’évaluation a été faite à partir des déclarations, sans inclusion active ou suivi des enfants ; aucune donnée n’a été directement recueillie auprès des parents ou des nourrissons. Les cas de gastro-entérites à RV ont été identifiés à l’aide d’un code diagnostique spécifique du rotavirus. Au total 33 140 nourrissons ont été vaccinés avec 3 doses de RotaTeq et 26 167 nourrissons dans un groupe de comparaison contemporain ont reçu DTCa, mais pas RotaTeq. La surveillance a été effectuée après 2 saisons de rotavirus et a commencé 14 jours après l’administration de la troisième dose dans les deux groupes ou après le début de chaque saison, et le suivi a été planifié jusqu’à la fin de chaque saison.
- L’efficacité sur le terrain du vaccin contre les gastro-entérites à RV était de 100 % (IC 95 % : 87-100) pour des hospitalisations et admissions dans les services d’urgence et de 96 % (IC 95 % : 76-100) pour des consultations médicales ambulatoires. L’efficacité du vaccin (pour hospitalisations et admissions dans les services d’urgence) contre les gastro-entérites de toute cause (rotavirus et autres causes) était de 59 % (IC 95 % : 47-68).
- Dans une étude observationnelle conduite dans le nord-ouest de la France chez des enfants de moins de 2 ans, 4684 enfants au total ont reçu au moins une dose de RotaTeq et la couverture pour un schéma vaccinal complet en trois doses a atteint 47,1 %. Tous les enfants se présentant au service médical régional avec des symptômes évoquant une gastro-entérite ont été inclus et les selles ont été recueillies pour l’identification du rotavirus. Un enfant a été hospitalisé pour gastro-entérite à RV confirmée parmi les 1895 enfants vaccinés avec le schéma complet comparativement à 47 enfants non vaccinés hospitalisés pour gastro-entérite à RV confirmée parmi les 2102 enfants de la même tranche d’âge. L’évaluation non ajustée de l’efficacité sur le terrain de RotaTeq dans la prévention des hospitalisations pour gastro-entérites à RV parmi les enfants de moins de 2 ans était de 98 % (IC 95 % : 83-100).
- Immunogénicité :
- Le mécanisme immunologique selon lequel RotaTeq protège contre les gastro-entérites à rotavirus n’est pas complètement compris. Aucun corrélat immunologique de protection n’a encore été identifié pour les vaccins à rotavirus. Dans les études de phase III, entre 92,5 % et 100 % des nourrissons ont montré une augmentation significative d’IgA sérique antirotavirus, après l’administration de 3 doses de RotaTeq. Le vaccin induit une réponse immune contre les 5 protéines de rotavirus humains exprimées sur les réassortants (G1, G2, G3, G4 et P[8]) [avec apparition d’anticorps sériques neutralisants].
PHARMACOCINÉTIQUE |
L’évaluation des propriétés pharmacocinétiques n’est pas requise pour les vaccins.
SÉCURITE PRÉCLINIQUE |
Une étude de toxicité orale à dose unique et à dose répétée chez la souris n’a pas révélé de risque particulier pour l’homme. La dose administrée à la souris était approximativement de 2,79 x 108 unités infectieuses par kg (environ 14 fois la dose prévue pour le nourrisson).
Il est improbable que RotaTeq représente un risque pour l’environnement.
Cf Modalités de manipulation et d’élimination.
INCOMPATIBILITÉS |
Ce vaccin ne doit pas être mélangé avec d’autres médicaments.
CONDITIONS DE CONSERVATION |
A conserver au réfrigérateur (2 °C – 8 °C).
Maintenir le tube unidose dans l’emballage extérieur à l’abri de la lumière.
RotaTeq doit être administré rapidement après avoir été sorti du réfrigérateur.
MODALITÉS MANIPULATION/ÉLIMINATION |
Le vaccin doit être administré oralement sans être mélangé avec d’autres vaccins ou solutions. Ne pas diluer.
Pour administrer le vaccin :- Ouvrir le sachet protecteur et retirer le tube unidose.
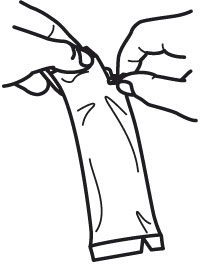
- Faire descendre le liquide du goulot du tube en tenant le tube verticalement et en tapotant sur le bouchon.
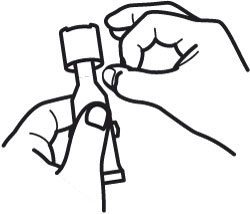
- Ouvrir le tube unidose en 2 mouvements simples :
- Percer le goulot du tube en vissant le bouchon dans le sens des aiguilles d’une montre jusqu’au blocage.
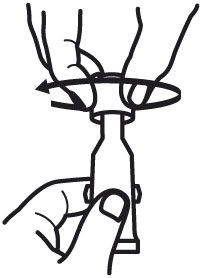
- Tourner le bouchon dans le sens inverse des aiguilles d’une montre pour le retirer.
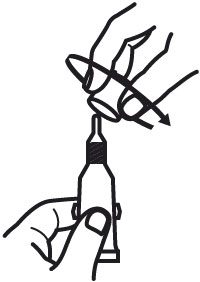
- Percer le goulot du tube en vissant le bouchon dans le sens des aiguilles d’une montre jusqu’au blocage.
- Placer l’embout dans la bouche contre l’intérieur de la joue du nourrisson. Administrer la dose en pressant délicatement le tube jusqu’à ce que celui-ci soit complètement vide. (Une goutte résiduelle peut rester dans le goulot.)
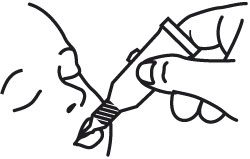
- Jeter le tube vide et le bouchon dans des conteneurs biologiques prévus à cet effet selon les recommandations locales.
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM | EU/1/06/348/001 ; CIP 3400937622363 (RCP rév 08.04.2011). |
| Non remb Séc soc. |
SANOFI PASTEUR MSD, SNC
8, rue Jonas-Salk. 69007 Lyon
Tél : 04 37 28 40 00. Fax : 04 37 28 44 00
Info médic et pharmacovigilance :
Tél : 08 25 82 22 46 (08 25 VACCIN)
Site web : http://www.spmsd.fr
Liste Des Sections Les Plus Importantes :
- pathologies
- Medicaments
- Medicaments injectables
- Traitement D’Urgence
- Guide Infirmier Des Examens De Laboratoire
- Infirmiers En Urgences
- Fiche Technique Medical
- Techniques De Manipulations En Radiologie Medicale
- Bibliotheque_medicale



