nilotinib
FORMES et PRÉSENTATIONS |
COMPOSITION |
| p gélule | |
| Nilotinib (DCI) chlorhydrate monohydraté exprimé en nilotinib | 150 mg |
| ou | 200 mg |
Teneur en lactose monohydraté : 117,08 mg/gélule à 150 mg ; 156,11 mg/gélule à 200 mg.
INDICATIONS |
- Tasigna 150 mg et 200 mg :
- Tasigna est indiqué chez l’adulte dans le traitement de la leucémie myéloïde chronique (LMC) chromosome Philadelphie positive en phase chronique nouvellement diagnostiquée.
- Tasigna 200 mg :
- Tasigna est indiqué chez l’adulte dans le traitement de la LMC chromosome Philadelphie positive (Ph+) en phase chronique et en phase accélérée, résistant ou intolérant à un traitement antérieur incluant l’imatinib. Les données d’efficacité chez les patients ayant une LMC en crise blastique ne sont pas disponibles.
POSOLOGIE ET MODE D’ADMINISTRATION |
- Traitement de la leucémie myéloïde chronique (LMC) en phase chronique nouvellement diagnostiquée (Tasigna 150 mg et 200 mg) : la posologie recommandée est de 300 mg deux fois par jour.
- Traitement de la LMC en phase chronique et en phase accélérée (Tasigna 200 mg) : la posologie recommandée est de 400 mg deux fois par jour.
Le traitement doit être poursuivi aussi longtemps que le patient en tire un bénéfice.
Pour une dose de 400 mg une fois par jour, les gélules à 200 mg sont disponibles (cf Adaptations de la posologie ci-dessous).
Coût du traitement journalier (4 gél à 200 mg) : 149,09 euro(s) (boîte de 28) ; 146,34 euro(s) (boîte de 112).- Adaptations ou modifications de la posologie :
- Il peut être nécessaire d’interrompre provisoirement le traitement par Tasigna et/ou réduire la posologie en cas de toxicités hématologiques (neutropénie, thrombopénie) non reliées à la leucémie sous-jacente (cf voir tableau 1).
-
Tableau 1 : Adaptations posologiques en cas de neutropénie et de thrombopénie LMC en phase chronique nouvellement diagnostiquée à la posologie de 300 mg 2 fois/jour (Tasigna 150 mg et 200 mg) et LMC en phase chronique en cas de résistance ou intolérance à l’imatinib à la posologie de 400 mg 2 fois/jour (Tasigna 200 mg) PN* < 1,0 × 109/l et/ou plaquettes < 50 × 109/l 1. Le traitement par Tasigna doit être interrompu et l’hémogramme doit être surveillé. - 2. Le traitement doit être repris dans les 2 semaines à la dose initiale si PN* > 1,0 × 109/l et/ou plaquettes > 50 × 109/l.
- 3. Si les valeurs de l’hémogramme restent faibles, il pourra être nécessaire de réduire la posologie à 400 mg 1 fois/jour.
LMC en phase accélérée en cas de résistance ou intolérance à l’imatinib à la posologie de 400 mg 2 fois/jour (Tasigna 200 mg) PN* < 0,5 × 109/l et/ou plaquettes < 10 × 109/l 1. Le traitement par Tasigna doit être interrompu et l’hémogramme doit être surveillé. - 2. Le traitement doit être repris dans les 2 semaines à la dose initiale, si PN* > 1,0 × 109/l et/ou plaquettes > 20 × 109/l.
- 3. Si les valeurs de l’hémogramme restent faibles, il pourra être nécessaire de réduire la posologie à 400 mg 1 fois/jour.
- 2. Le traitement doit être repris dans les 2 semaines à la dose initiale si PN* > 1,0 × 109/l et/ou plaquettes > 50 × 109/l.
-
*
PN = polynucléaires neutrophiles
- En cas de toxicité extrahématologique modérée ou sévère cliniquement significative, le traitement doit être interrompu et il pourra être repris à la dose de 400 mg une fois par jour après résolution de la toxicité. Si cela est cliniquement justifié, une nouvelle augmentation, à une dose initiale de 300 mg deux fois par jour chez les patients atteints de LMC en phase chronique nouvellement diagnostiquée (Tasigna 150 mg et 200 mg) ou à 400 mg deux fois par jour chez les patients atteints de LMC en phase chronique et en phase accélérée résistants ou intolérants à l’imatinib (Tasigna 200 mg), doit être envisagée.
- Élévation des taux sériques de lipase : en cas d’élévation des taux sériques de lipase de grade 3 ou 4, il faut réduire la posologie à 400 mg une fois par jour ou interrompre le traitement. Les taux sériques de lipase doivent être contrôlés une fois par mois ou lorsque cela est cliniquement justifié (cf Mises en garde et Précautions d’emploi).
- Élévation de la bilirubine et des transaminases hépatiques : en cas d’élévation de la bilirubine et des transaminases hépatiques de grade 3 ou 4, il faut réduire la posologie à 400 mg une fois par jour ou interrompre le traitement. La bilirubinémie et les taux de transaminases hépatiques doivent être contrôlés une fois par mois ou lorsque cela est cliniquement justifié.
- Population pédiatrique :
- La sécurité et l’efficacité de Tasigna dans la population pédiatrique à partir de la naissance jusqu’à 18 ans n’ont pas encore été établies (cf Pharmacodynamie). L’utilisation dans la population pédiatrique n’est donc pas recommandée, compte tenu de l’insuffisance de données concernant la sécurité et l’efficacité.
- Patients âgés :
- Environ 12 % des patients dans l’étude de phase III menée chez les patients atteints de LMC en phase chronique nouvellement diagnostiquée et 30 % environ des patients dans l’étude de phase II menée chez les patients atteints de LMC en phase chronique et en phase accélérée résistants ou intolérants à l’imatinib étaient âgés de 65 ans et plus. Aucune différence notable n’a été observée en termes de sécurité et d’efficacité chez les patients de 65 ans et plus par rapport aux adultes âgés de 18 à 65 ans.
- Insuffisance rénale :
- Il n’a pas été mené d’études cliniques chez les patients insuffisants rénaux.
- Comme le nilotinib et ses métabolites ne sont pas excrétés par voie rénale, une diminution de la clairance corporelle totale est peu probable chez les patients présentant une insuffisance rénale.
- Insuffisance hépatique :
- L’insuffisance hépatique a un effet modéré sur la pharmacocinétique du nilotinib. Il n’est pas nécessaire d’adapter la posologie chez les patients atteints d’insuffisance hépatique. Toutefois, la prudence est requise chez ces patients (cf Mises en garde et Précautions d’emploi).
- Affections cardiaques :
- Au cours des études cliniques, les patients présentant une maladie cardiaque non contrôlée ou significative (par exemple un infarctus du myocarde récent, une insuffisance cardiaque congestive, un angor instable ou une bradycardie cliniquement significative) ont été exclus. La prudence est requise chez les patients présentant une affection cardiaque (cf Mises en garde et Précautions d’emploi).
Mode d’administration :
Tasigna doit être pris deux fois par jour à 12 heures d’intervalle environ en dehors des repas et ne doit pas être pris avec de la nourriture. La gélule doit être avalée entière avec de l’eau. Aucun aliment ne doit être consommé pendant les 2 heures précédant la prise du médicament et pendant 1 heure au moins après celle-ci.
En cas d’oubli d’une dose, le patient ne doit pas prendre une dose supplémentaire, mais prendre la dose suivante selon le schéma posologique habituel.
Pour les patients qui ne peuvent avaler les gélules, le contenu de chaque gélule peut être dispersé dans une cuillère à café de compote de pommes et doit être avalé immédiatement. Il ne doit pas être utilisé plus d’une cuillère à café de compote de pommes ou d’autres aliments que la compote de pommes (cf Mises en garde et Précautions d’emploi, Pharmacocinétique).
Tasigna peut être administré en association avec des facteurs de croissance hématopoïétiques tels que l’érythropoïétine ou le facteur de croissance des granulocytes (G-CSF), si cela est cliniquement indiqué. Tasigna peut être administré avec l’hydroxyurée ou l’anagrélide si cela est cliniquement indiqué.
CONTRE-INDICATIONS |
MISES EN GARDE et PRÉCAUTIONS D’EMPLOI |
- Aplasie médullaire :
- Le traitement par Tasigna est associé à une thrombopénie, une neutropénie et une anémie (de grade 3/4 selon la classification internationale « National Cancer Institute Common Toxicity Criteria »). Leur incidence est plus fréquente chez les patients atteints de LMC résistants ou intolérants à l’imatinib, en particulier chez les patients en phase accélérée. Il convient de pratiquer un hémogramme complet toutes les deux semaines pendant les deux premiers mois, et une fois par mois ensuite, ou lorsque cela est cliniquement justifié. En général, l’aplasie médullaire a été réversible et elle a pu être traitée par une interruption temporaire du traitement par Tasigna ou en diminuant la posologie (cf Posologie et Mode d’administration).
- Allongement de l’intervalle QT :
- On a constaté que Tasigna entraîne un allongement dose-dépendant de la repolarisation ventriculaire cardiaque (mesurée par l’intervalle QT sur l’ECG).
- Dans l’étude de phase III menée chez les patients atteints de LMC en phase chronique nouvellement diagnostiquée recevant 300 mg de nilotinib deux fois par jour, la variation moyenne de l’intervalle QTcF à l’état d’équilibre a été de 6 ms par rapport aux valeurs initiales. Aucun patient n’a présenté d’intervalle QTcF > 480 ms. On n’a observé aucun épisode de torsades de pointes.
- Dans l’étude de phase II (Tasigna 200 mg) menée chez les patients atteints de LMC en phase chronique et en phase accélérée résistants ou intolérants à l’imatinib recevant 400 mg de nilotinib deux fois par jour, la variation moyenne de l’intervalle QTcF dans des conditions standard a été de 5 ms et 8 ms respectivement par rapport aux valeurs initiales. Un intervalle QTcF > 500 ms a été observé chez moins de 1 % des patients. Au cours des études cliniques, on n’a observé aucun épisode de torsades de pointes.
- Dans une étude menée chez des volontaires sains au cours de laquelle les expositions ont été comparables à celles observées chez les patients, la variation moyenne de l’intervalle QTcF, après soustraction des valeurs obtenues avec le placebo, a été de 7 ms par rapport aux valeurs initiales (IC ± 4 ms). Aucun patient n’a présenté d’intervalle QTcF supérieur à 450 ms. En outre, aucun cas d’arythmies cliniquement significatives n’a été observé pendant l’étude, et notamment aucun épisode de torsades de pointe (transitoires ou persistantes).
- Un allongement significatif de l’intervalle QT peut survenir en cas de prise inappropriée de nilotinib avec des inhibiteurs puissants du CYP3A4 et/ou des médicaments connus comme étant susceptibles d’induire un allongement de l’intervalle QT et/ou des aliments (cf Interactions). En présence d’une hypokaliémie ou d’une hypomagnésémie, cet effet peut se renforcer. Un allongement de l’intervalle QT peut exposer les patients à un risque de complications fatales.
- Tasigna doit être utilisé avec prudence chez les patients présentant un allongement de l’intervalle QTc ou présentant un risque significatif de développer un allongement de l’intervalle QTc, tels que ceux :
- présentant un allongement congénital de l’intervalle QT ;
- présentant une maladie cardiaque non contrôlée ou significative (y compris un infarctus du myocarde récent, une insuffisance cardiaque congestive, un angor instable ou une bradycardie cliniquement significative) ;
- prenant des médicaments antiarythmiques ou d’autres substances entraînant un allongement de l’intervalle QT.
- présentant un allongement congénital de l’intervalle QT ;
- Il est conseillé de surveiller étroitement un effet sur l’intervalle QTc et de réaliser un ECG initial avant l’instauration du traitement par Tasigna et lorsque cela est cliniquement justifié. L’hypokaliémie ou l’hypomagnésémie doivent être corrigées avant de débuter le traitement par Tasigna, et ces paramètres doivent être surveillés périodiquement au cours du traitement.
- Mort subite :
- Des cas peu fréquents (0,1 à 1 %) de mort subite ont été rapportés chez des patients atteints de LMC en phase chronique ou en phase accélérée résistants ou intolérants à l’imatinib et présentant dans leurs antécédents des pathologies cardiaques ou des facteurs de risques cardiaques significatifs. Des pathologies associées à l’hémopathie sous-jacente ainsi que des traitements concomitants étaient aussi fréquemment présents. Les anomalies de repolarisation ventriculaire ont pu être des facteurs contributifs. Aucun cas de mort subite n’a été rapporté dans l’étude de phase III menée chez les patients atteints de LMC en phase chronique nouvellement diagnostiquée.
- Interactions avec d’autres médicaments :
- L’administration concomitante de Tasigna avec des inhibiteurs puissants du CYP3A4 (incluant, mais de manière non exhaustive, kétoconazole, itraconazole, voriconazole, clarithromycine, télithromycine, ritonavir) doit être évitée. Si l’administration d’un de ces produits s’avère nécessaire, il est recommandé si possible d’interrompre le traitement par Tasigna (cf Interactions). Si l’interruption temporaire du traitement n’est pas possible, une surveillance étroite du patient est recommandée, afin de déceler un éventuel allongement de l’intervalle QT (cf Posologie et Mode d’administration, Interactions, Pharmacocinétique).
- L’utilisation concomitante de Tasigna et d’inducteurs puissants du CYP3A4 (par ex phénytoïne, rifampicine, carbamazépine, phénobarbital ou le millepertuis) réduit vraisemblablement l’exposition au nilotinib de manière cliniquement significative. Par conséquent, chez les patients recevant Tasigna, les médicaments administrés de manière concomitante devront être choisis pour avoir un faible potentiel d’induction du CYP3A4 (cf Interactions).
- Effets des aliments :
- La biodisponibilité du nilotinib est augmentée par la prise alimentaire. Tasigna ne doit pas être pris avec des aliments (cf Posologie et Mode d’administration, Interactions) et il doit être pris 2 heures après un repas. Le patient ne doit consommer aucun aliment pendant une heure au moins après la prise du médicament. Le jus de pamplemousse et les autres aliments connus pour inhiber le CYP3A4 doivent être évités. Pour les patients qui ne peuvent avaler les gélules, le contenu de chaque gélule peut être dispersé dans une cuillère à café de compote de pommes et doit être avalé immédiatement. Il ne doit pas être utilisé plus d’une cuillère à café de compote de pommes ou d’autres aliments que la compote de pommes (cf Pharmacocinétique).
- Insuffisance hépatique :
- L’insuffisance hépatique a un effet modéré sur la pharmacocinétique du nilotinib. L’administration unique d’une dose de 200 mg de nilotinib a entraîné des augmentations de l’AUC de 35 %, 35 % et 19 % respectivement, chez des patients présentant une insuffisance hépatique légère, modérée et sévère par rapport aux sujets du groupe contrôle présentant une fonction hépatique normale. Le Cmax prédictif à l’état d’équilibre du nilotinib était augmenté respectivement de 29 %, 18 % et 22 %. Au cours des études cliniques, les patients présentant des taux de l’alanine aminotransférase (ALAT) et/ou de l’aspartate aminotransférase (ASAT) > 2,5 fois la limite supérieure de la normale (ou > 5 × LSN, si l’augmentation était liée à la maladie) et/ou des taux de bilirubine totale > 1,5 fois la LSN, étaient exclus. Le métabolisme du nilotinib est essentiellement hépatique. Les patients atteints d’insuffisance hépatique peuvent avoir une exposition augmentée au nilotinib et doivent donc être traités avec prudence (cf Posologie et Mode d’administration).
- Taux sériques de lipase :
- On a observé une élévation des taux sériques de lipase. Il est conseillé d’être prudent chez les patients ayant des antécédents de pancréatite. En cas d’élévation du taux de lipases associée à des symptômes abdominaux, le traitement par Tasigna doit être interrompu et des mesures appropriées pour établir le diagnostic et exclure une pancréatite doivent être envisagées.
- Gastrectomie totale :
- La biodisponibilité du nilotinib peut être diminuée chez des patients ayant une gastrectomie totale (cf Pharmacocinétique). Un suivi plus fréquent de ces patients doit être envisagé.
- Lactose :
- Les gélules de Tasigna contiennent du lactose (cf Composition). Les patients présentant un problème héréditaire rare d’intolérance au galactose, un déficit en lactase de Lapp, ou une malabsorption glucose-galactose ne doivent pas prendre ce médicament.
INTERACTIONS |
- Substances susceptibles d’augmenter les concentrations plasmatiques de nilotinib :
- Le nilotinib est essentiellement métabolisé dans le foie. C’est également un substrat de la pompe à efflux de nombreux médicaments, la glycoprotéine P (P-gp). Par conséquent, les substances exerçant un effet sur le CYP3A4 et/ou la P-gp peuvent influencer l’absorption et l’élimination du nilotinib absorbé par voie systémique. L’association du nilotinib et de l’imatinib (substrat et modulateur de la P-gp et du CYP3A4) exerce un faible pouvoir inhibiteur du CYP3A4 et de la P-gp. Les AUC du nilotinib et de l’imatinib sont augmentées de 18 % à 40 %. Ces variations sont vraisemblablement sans pertinence clinique.
- Chez des sujets sains, l’exposition au nilotinib était multipliée par 3 en cas d’administration concomitante de kétoconazole, un inhibiteur puissant du CYP3A4. Il faut donc éviter le traitement concomitant par des inhibiteurs puissants du CYP3A4, tels que kétoconazole, itraconazole, voriconazole, ritonavir, clarithromycine et télithromycine (cf Posologie et Mode d’administration, Mises en garde et Précautions d’emploi). On peut également s’attendre à une exposition augmentée au nilotinib avec les inhibiteurs modérés du CYP3A4. L’utilisation d’autres médicaments concomitants inhibant faiblement ou n’inhibant pas le CYP3A4 doit être envisagée.
- Substances susceptibles de diminuer les concentrations plasmatiques de nilotinib :
- La rifampicine, un puissant inducteur du CYP3A4, diminue de 64 % la Cmax du nilotinib et réduit l’AUC du nilotinib de 80 %. La rifampicine et le nilotinib ne doivent pas être administrés de façon concomitante.
- L’administration concomitante des autres médicaments inducteurs du CYP3A4 (par ex phénytoïne, carbamazépine, phénobarbital ou le millepertuis) diminue aussi probablement l’exposition au nilotinib de manière cliniquement significative. Chez les patients pour lesquels les inducteurs du CYP3A4 sont indiqués, des thérapeutiques alternatives entraînant une induction enzymatique plus faible doivent être utilisées.
- La solubilité du nilotinib dépend du pH, avec une solubilité plus faible à pH élevé. Chez des volontaires sains ayant reçu de l’ésoméprazole à 40 mg une fois par jour pendant 5 jours, le pH gastrique a été augmenté de façon significative mais l’absorption de nilotinib n’a été diminuée que de façon modeste (diminution de la Cmax de 27 % et augmentation de AUC0-infini de 34 %). Le nilotinib peut être utilisé de façon concomitante avec l’ésoméprazole ou d’autres inhibiteurs de la pompe à protons si nécessaire.
- Substances dont les concentrations plasmatiques sont susceptibles d’être modifiées par le nilotinib :
- In vitro, le nilotinib est un inhibiteur relativement puissant du CYP3A4, du CYP2C8, du CYP2C9, du CYP2D6 et de l’UGT1A1, avec une valeur du Ki qui est plus basse pour le CYP2C9 (Ki = 0,13 µmol/l).
- Dans une étude d’interaction menée chez des sujets sains avec une dose unique de 25 mg de warfarine, substrat sensible du CYP2C9, une dose de 800 mg de nilotinib n’a pas entraîné de changements des paramètres pharmacocinétiques ou pharmacodynamiques de la warfarine tels que le temps de Quick et l’INR. Il n’existe pas de données à l’état d’équilibre. Cette étude suggère qu’une interaction médicamenteuse entre le nilotinib et la warfarine est cliniquement moins significative pour des doses allant jusqu’à 25 mg de warfarine. En l’absence de données à l’état d’équilibre, un contrôle des marqueurs pharmacodynamiques de la warfarine (INR ou temps de Quick) est recommandé après l’initiation d’un traitement par le nilotinib (au moins pendant les 2 premières semaines).
- De plus, chez des sujets sains, l’administration concomitante d’une dose unique de Tasigna et de midazolam administré par voie orale a augmenté de 30 % l’exposition au midazolam. On ne peut exclure une augmentation de l’effet du nilotinib à l’état d’équilibre. La prudence est requise en cas d’administration concomitante de Tasigna et de substrats de ces enzymes ayant un index thérapeutique étroit (par exemple astémizole, terfénadine, cisapride, pimozide, quinidine, bépridil ou les alcaloïdes de l’ergot de seigle [ergotamine, dihydroergotamine]).
- Médicaments antiarythmiques et autres substances susceptibles d’allonger l’intervalle QT :
- Il faut utiliser le nilotinib avec prudence chez les patients présentant ou pouvant développer un allongement de l’intervalle QT, notamment les patients prenant des médicaments antiarythmiques tels que amiodarone, disopyramide, procaïnamide, quinidine ou sotalol, ou d’autres médicaments qui peuvent entraîner un allongement de l’intervalle QT tels que chloroquine, halofantrine, clarithromycine, halopéridol, méthadone ou moxifloxacine (cf Mises en garde et Précautions d’emploi).
Autres interactions susceptibles de modifier les concentrations plasmatiques : la prise alimentaire augmente l’absorption de Tasigna, ayant pour résultat une augmentation de la concentration plasmatique (cf Posologie et Mode d’administration, Mises en garde et Précautions d’emploi, Pharmacocinétique). Le jus de pamplemousse et les autres aliments connus pour inhiber le CYP3A4 doivent être évités.
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Les femmes en âge d’avoir des enfants doivent utiliser une méthode contraceptive efficace au cours du traitement par Tasigna.
Grossesse :
Il n’existe pas de données pertinentes concernant l’utilisation du nilotinib chez la femme enceinte. Des études menées chez l’animal ont mis en évidence une toxicité sur la reproduction (cf Sécurité préclinique). Tasigna ne doit pas être utilisé pendant la grossesse à moins que la situation clinique de la femme justifie le traitement par le nilotinib. En cas d’utilisation en cours de grossesse, la patiente doit être informée des risques potentiels pour le foetus.
Allaitement :
On ne sait pas si le nilotinib est excrété dans le lait maternel de la femme. Les données toxicologiques disponibles chez l’animal ont mis en évidence l’excrétion de nilotinib dans le lait (cf Sécurité préclinique). Un risque pour les nouveau-nés/nourrissons ne peut être exclu. Tasigna ne doit pas être pris pendant l’allaitement.
Fécondité :Des études effectuées chez l’animal n’ont pas montré d’effet sur la fertilité chez les rats mâles et femelles (cf Sécurité préclinique).
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
- LMC nouvellement diagnostiquée en phase chronique :
- A la date d’analyse de l’étude de phase III, 64 % des patients ont été exposés à Tasigna pendant plus de 12 mois et 16,5 % des patients l’ont été pendant plus de 18 mois. La durée médiane d’exposition était de 14 mois.
- Les effets indésirables extrahématologiques les plus fréquents étaient une éruption, un prurit, des céphalées, des nausées, une fatigue et des myalgies. La plupart de ces effets indésirables étaient de sévérité légère à modérée. On a observé des effets indésirables moins fréquents, tels que douleurs abdominales supérieures, alopécie, constipation, diarrhée, asthénie, sécheresse cutanée, spasmes musculaires, arthralgies, vomissements, douleurs abdominales et oedème périphérique, et ces effets étaient de sévérité légère à modérée. Que la relation de causalité ait été établie ou non, 6,8 % des patients ont arrêté leur traitement en raison de ces effets indésirables.
- Les toxicités hématologiques induites par le traitement consistent en une myélosuppression : une thrombopénie (17 %), une neutropénie (14 %) et une anémie (6 %). Des épanchements pleuraux et péricardiques ont été rapportés chez < 1 % des patients traités par Tasigna. Des hémorragies gastro-intestinales ont été rapportées chez < 1 % des patients.
- La variation moyenne de l’intervalle QTcF à l’état d’équilibre a été de 6 ms. Aucun patient n’a présenté d’intervalle QTcF > 480 ms. Une augmentation de l’intervalle QTcF par rapport à l’état initial de plus de 60 msec a été observée chez < 1 % des patients. Aucune mort subite et aucun épisode de torsades de pointes (transitoires ou maintenues) n’a été observé. Aucune réduction de la fraction d’éjection ventriculaire gauche par rapport à l’état initial n’a été observée à aucun moment au cours du traitement. Aucun patient n’a présenté une fraction d’éjection ventriculaire gauche < 45 % au cours du traitement ni de réduction en valeur absolue de la fraction d’éjection ventriculaire gauche de plus de 15 %.
- LMC en phase chronique et en phase accélérée en cas de résistance et d’intolérance à l’imatinib (Tasigna 200 mg) :
- Les données décrites ci-dessous sont le reflet d’une exposition à Tasigna chez 458 patients au cours d’une étude clinique de phase II, en ouvert, multicentrique, chez des patient résistants ou intolérants à l’imatinib atteints de LMC en phase chronique (n = 321) et phase accélérée (n = 137) traités à la dose recommandée de 400 mg deux fois par jour. La durée médiane d’exposition en jours était de 561 (1-1096) jours chez les patients atteints de LMC-PC et de 264 (2-1160) jours chez les patients atteints de LMC-PA.
- Les effets indésirables extrahématologiques les plus fréquents et associés au médicament étaient une éruption, un prurit, des nausées, une fatigue, des céphalées, des douleurs abdominales, une constipation et des diarrhées. La plupart de ces effets indésirables étaient de sévérité légère à modérée. On a observé fréquemment des effets indésirables de sévérité légère à modérée (grade 1 et 2), tels que vomissements, myalgies, alopécie, spasmes musculaires, anorexie, arthralgies, douleurs osseuses, oedème périphérique et asthénie. Au total, 16 % des patients en PC et 10 % des patients en PA ont arrêté leur traitement en raison de ces effets indésirables associés au médicament.
- Les toxicités hématologiques induites par le traitement consistent en une myélosuppression : une thrombopénie (31 %), une neutropénie (17 %) et une anémie (14 %). Des épanchements pleuraux et péricardiques, ainsi que des complications d’une rétention hydrique, ont été rapportées chez < 1 % des patients traités par Tasigna. Une insuffisance cardiaque a été observée chez < 1 % des patients. Des hémorragies gastro-intestinales et du SNC ont été rapportées respectivement chez 1 % et < 1 % des patients.
- Un allongement de l’intervalle QTcF > 500 ms a été observé chez < 1 % des patients. Aucun épisode de torsades de pointes (transitoires ou persistantes) n’a été observé.
- Effets indésirables le plus fréquemment rapportés dans les études cliniques de Tasigna :
- Les effets indésirables extrahématologiques (à l’exception des anomalies biologiques) rapportés chez au moins 5 % des patients traités par 300 mg de nilotinib deux fois par jour lors d’études cliniques menées avec Tasigna sont décrits dans le tableau 2. Ces effets sont classés par ordre de fréquence, selon la convention suivante : très fréquent (>= 1/10), fréquent (>= 1/100, < 1/10), peu fréquent (>= 1/1000, < 1/100), rare (>= 1/10 000, < 1/1000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Au sein de chaque fréquence de groupe, les effets indésirables sont présentés par ordre décroissant de sévérité.
-
Tableau 2 : Effets indésirables non hématologiques (>= 5 % de tous les patients) LMC-PC nouvellement diagnostiquée : 300 mg 2 fois/jour (n = 279) Classification par systèmes d’organes/
Effet indésirableFréquence Tous les grades
%Grades 3-4
%Troubles du métabolisme et de la nutrition : Anorexie (Tasigna 200 mg) Fréquent 2 0 Affections du système nerveux : Céphalées Très fréquent 14 1 Affections gastro-intestinales : Nausées Très fréquent 12 < 1 Constipation Fréquent 8 0 Diarrhée Fréquent 8 < 1 Vomissements Fréquent 5 0 Douleurs abdominales supérieures Fréquent 9 < 1 Douleurs abdominales Fréquent 5 0 Affections de la peau et du tissu sous-cutané : Éruption Très fréquent 31 < 1 Prurit Très fréquent 15 < 1 Alopécie Fréquent 8 0 Sécheresse cutanée Fréquent 7 0 Affections musculosquelettiques et systémiques : Myalgies Très fréquent 10 < 1 Arthralgies Fréquent 6 0 Spasmes musculaires Fréquent 7 0 Douleurs osseuses (Tasigna 200 mg) Fréquent 4 0 Troubles généraux et anomalies au site d’administration : Fatigue Très fréquent 11 0 Asthénie Fréquent 7 < 1 OEdème périphérique Fréquent 5 0 -
LMC-PC et LMC-PA en cas de résistance et d’intolérance à l’imatinib : 400 mg 2 fois/jour (n = 458) Classification par systèmes d’organes/
Effet indésirableFréquence Tous les grades
%Grades 3-4
%CML-CP (n = 321)
Grades 3-4
%CML-AP (n = 137)
Grades 3-4
%Troubles du métabolisme et de la nutrition : Anorexie Fréquent 7 < 1 < 1 0 Affections du système nerveux : Céphalées Très fréquent 15 1 2 < 1 Affections gastro-intestinales : Nausées Très fréquent 20 < 1 < 1 < 1 Constipation Très fréquent 12 < 1 < 1 0 Diarrhée Très fréquent 11 2 2 < 1 Vomissements Fréquent 10 < 1 < 1 0 Douleurs abdominales supérieures Fréquent 5 < 1 < 1 0 Douleurs abdominales Fréquent 6 < 1 < 1 < 1 Affections de la peau et du tissu sous-cutané : Éruption Très fréquent 28 1 2 0 Prurit Très fréquent 24 < 1 < 1 0 Alopécie Fréquent 9 0 0 0 Sécheresse cutanée Fréquent 5 0 0 0 Érythème Fréquent 5 < 1 < 1 0 Affections musculosquelettiques et systémiques : Myalgies Fréquent 10 < 1 < 1 < 1 Arthralgies Fréquent 7 < 1 1 0 Spasmes musculaires Fréquent 8 < 1 < 1 0 Douleurs osseuses Fréquent 6 < 1 < 1 0 Douleurs des extrémités Fréquent 5 < 1 < 1 < 1 Troubles généraux et anomalies au site d’administration : Fatigue Très fréquent 17 1 1 < 1 Asthénie Fréquent 6 < 1 0 < 1 OEdème périphérique Fréquent 6 0 0 0 - Lors des études cliniques menées avec Tasigna, les effets indésirables suivants ont été rapportés à une fréquence inférieure à 5 %. Pour les anomalies biologiques, les effets très fréquents (>= 1/10) non inclus dans le tableau 2 ont également été rapportés. Ces effets indésirables sont présentés sur la base de leur pertinence clinique et sont classés par ordre décroissant de sévérité au sein de chaque catégorie.
-
- Tasigna 150 mg :
- Infections et infestations :
- Fréquent : folliculite.
- Peu fréquent : infection des voies respiratoires supérieures.
- Fréquence indéterminée : infection des voies respiratoires, infection à Herpes simplex, candidose orale, abcès sous-cutané, abcès anal, furoncle, rhinopharyngite, rhinite, Tinea pedis (dermatomycose du pied).
- Fréquent : folliculite.
- Tumeurs bénignes, malignes et non précisées (incluant kystes et polypes) :
- Fréquent : papillome cutané.
- Fréquence indéterminée : papillome.
- Fréquent : papillome cutané.
- Affections hématologiques et du système lymphatique :
- Fréquent : lymphopénie.
- Peu fréquent : pancytopénie.
- Fréquence indéterminée : neutropénie fébrile.
- Fréquent : lymphopénie.
- Affections du système immunitaire :
- Fréquence indéterminée : hypersensibilité.
- Fréquence indéterminée : hypersensibilité.
- Affections endocriniennes :
- Fréquence indéterminée : hyperparathyroïdie secondaire.
- Fréquence indéterminée : hyperparathyroïdie secondaire.
- Troubles du métabolisme et de la nutrition :
- Fréquent : hypokaliémie, diabète, hypercholestérolémie, hyperlipidémie, hyperglycémie, hypophosphatémie, anorexie.
- Peu fréquent : hyperkaliémie, hypocalcémie, diminution de l’appétit.
- Fréquence indéterminée : hyperuricémie, goutte, hypoglycémie, dyslipidémie, altération de l’appétit.
- Fréquent : hypokaliémie, diabète, hypercholestérolémie, hyperlipidémie, hyperglycémie, hypophosphatémie, anorexie.
- Affections psychiatriques :
- Fréquent : insomnie.
- Peu fréquent : anxiété.
- Fréquence indéterminée : humeur dépressive, amnésie, dysphorie.
- Fréquent : insomnie.
- Affections du système nerveux :
- Fréquent : vertiges, hypoesthésie.
- Peu fréquent : paresthésies.
- Fréquence indéterminée : syncope, migraine, tremblements, neuropathie périphérique, léthargie, dysesthésie.
- Fréquent : vertiges, hypoesthésie.
- Affections oculaires :
- Fréquent : prurit oculaire, conjonctivite, oeil sec.
- Peu fréquent : oedème palpébral, photopsie.
- Fréquence indéterminée : oedème périorbitaire, irritation oculaire, blépharite, douleurs oculaires, choriorétinopathie, hémorragie conjonctivale, conjonctivite allergique, hyperémie conjonctivale, hyperémie oculaire, maladie de la surface oculaire, hyperémie sclérale.
- Fréquent : prurit oculaire, conjonctivite, oeil sec.
- Affections de l’oreille et du labyrinthe :
- Fréquent : vertiges.
- Fréquent : vertiges.
- Affections cardiaques :
- Fréquent : allongement de l’intervalle QT à l’électrocardiogramme, palpitations.
- Peu fréquent : cyanose.
- Fréquence indéterminée : arythmies, diminution de la fraction d’éjection, épanchement péricardique, bradycardie sinusale.
- Fréquent : allongement de l’intervalle QT à l’électrocardiogramme, palpitations.
- Affections vasculaires :
- Fréquent : hypertension, bouffées vasomotrices.
- Fréquence indéterminée : hématome.
- Fréquent : hypertension, bouffées vasomotrices.
- Affections respiratoires, thoraciques et médiastinales :
- Fréquent : dyspnée, toux.
- Fréquence indéterminée : épanchement pleural, dyspnée d’effort, pleurésie, épistaxis.
- Fréquent : dyspnée, toux.
- Affections gastro-intestinales :
- Fréquent : distension abdominale, inconfort abdominal, dyspepsie, flatulence.
- Peu fréquent : pancréatite, douleurs oesophagiennes, dysgueusie.
- Fréquence indéterminée : ulcère oesophagien, ulcère gastrique, stomatite, sécheresse buccale, gastrite, hémorroïdes, hernie hiatale, hémorragie rectale, sensibilité dentaire, gingivite.
- Fréquent : distension abdominale, inconfort abdominal, dyspepsie, flatulence.
- Affections hépatobiliaires :
- Fréquent : fonction hépatique anormale.
- Peu fréquent : hépatite, ictère.
- Fréquence indéterminée : hépatotoxicité.
- Fréquent : fonction hépatique anormale.
- Affections de la peau et du tissu sous-cutané :
- Fréquent : érythème, hyperhidrose, contusion, acné, dermatose, sueurs nocturnes.
- Peu fréquent : éruption médicamenteuse, douleurs cutanées.
- Fréquence indéterminée : eczéma, urticaire, éruption bulleuse, kystes épidermoïdes, hyperplasie sébacée, oedème facial, atrophie cutanée, hypertrophie cutanée, desquamation cutanée, hyperpigmentation cutanée, décoloration cutanée.
- Fréquent : érythème, hyperhidrose, contusion, acné, dermatose, sueurs nocturnes.
- Affections musculosquelettiques et systémiques :
- Fréquent : douleurs osseuses, douleurs aux extrémités, douleurs dorsales.
- Peu fréquent : douleurs musculaires, douleurs.
- Fréquence indéterminée : faiblesse musculaire, douleurs costales.
- Fréquent : douleurs osseuses, douleurs aux extrémités, douleurs dorsales.
- Affections du rein et des voies urinaires :
- Fréquence indéterminée : dysurie, pollakiurie, chromaturie.
- Fréquence indéterminée : dysurie, pollakiurie, chromaturie.
- Affections des organes de reproduction et du sein :
- Fréquence indéterminée : gynécomastie, induration mammaire, ménorragie, oedème mamelonnaire.
- Fréquence indéterminée : gynécomastie, induration mammaire, ménorragie, oedème mamelonnaire.
- Troubles généraux et anomalies au site d’administration :
- Fréquent : pyrexie, douleur thoracique, gêne thoracique.
- Peu fréquent : frissons.
- Fréquence indéterminée : oedème facial, malaise, sensations de chaleur, oedème localisé.
- Fréquent : pyrexie, douleur thoracique, gêne thoracique.
- Investigations :
- Fréquent : diminution du taux plaquettaire, augmentation des taux sanguins d’amylase, augmentation des taux sanguins de phosphatases alcalines, gain de poids.
- Peu fréquent : diminution du taux d’hémoglobine, diminution du taux de neutrophiles, diminution de la phosphorémie, augmentation du taux de gamma-glutamyltransférase.
- Fréquence indéterminée : augmentation de l’insulinémie, diminution des lipoprotéines de très faible densité, augmentation du taux sanguin de la parathormone, augmentation de la kaliémie, augmentation de la pression artérielle, diminution du taux des leucocytes, perte de poids.
- Fréquent : diminution du taux plaquettaire, augmentation des taux sanguins d’amylase, augmentation des taux sanguins de phosphatases alcalines, gain de poids.
-
- Tasigna 200 mg :
- Infections et infestations :
- Fréquent : folliculite.
- Peu fréquent : pneumonie, infection des voies urinaires, gastro-entérite, infection des voies respiratoires supérieures, bronchites, infection du virus de l’herpès, candidoses.
- Fréquence indéterminée : septicémie, infection des voies respiratoires, abcès sous-cutané, abcès anal, furoncle, rhinopharyngite, rhinite, Tinea pedis (dermatomycose du pied).
- Fréquent : folliculite.
- Tumeurs bénignes, malignes et non précisées (incluant kystes et polypes) :
- Fréquent : papillome cutané.
- Fréquence indéterminée : papillome.
- Fréquent : papillome cutané.
- Affections hématologiques et du système lymphatique :
- Fréquent : neutropénie fébrile, pancytopénie, lymphopénie.
- Peu fréquent : thrombocytémie, leucocytose.
- Fréquent : neutropénie fébrile, pancytopénie, lymphopénie.
- Affections du système immunitaire :
- Fréquence indéterminée : hypersensibilité.
- Fréquence indéterminée : hypersensibilité.
- Affections endocriniennes :
- Peu fréquent : hyperthyroïdie, hypothyroïdie.
- Fréquence indéterminée : hyperparathyroïdie secondaire, thyroïdite.
- Peu fréquent : hyperthyroïdie, hypothyroïdie.
- Troubles du métabolisme et de la nutrition :
- Fréquent : déséquilibre des électrolytes (incluant hypomagnésémie, hyperkaliémie, hypokaliémie, hyponatrémie, hypocalcémie, hypophosphatémie, hypercalcémie, hyperphosphatémie), diabète, hyperglycémie, hypercholestérolémie, hyperlipidémie.
- Peu fréquent : déshydratation, diminution de l’appétit, augmentation de l’appétit.
- Fréquence indéterminée : hyperuricémie, goutte, hypoglycémie, dyslipidémie.
- Fréquent : déséquilibre des électrolytes (incluant hypomagnésémie, hyperkaliémie, hypokaliémie, hyponatrémie, hypocalcémie, hypophosphatémie, hypercalcémie, hyperphosphatémie), diabète, hyperglycémie, hypercholestérolémie, hyperlipidémie.
- Affections psychiatriques :
- Fréquent : dépression, insomnie.
- Peu fréquent : anxiété.
- Fréquence indéterminée : désorientation, confusion mentale, amnésie, dysphorie.
- Fréquent : dépression, insomnie.
- Affections du système nerveux :
- Fréquent : vertiges, hypoesthésie, paresthésies.
- Peu fréquent : hémorragie intracrânienne, migraine, perte de conscience (incluant syncope), tremblements, troubles de l’attention, hyperesthésie.
- Fréquence indéterminée : oedème cérébral, névrite optique, neuropathie périphérique, léthargie, dysesthésie.
- Fréquent : vertiges, hypoesthésie, paresthésies.
- Affections oculaires :
- Fréquent : hémorragie oculaire, oedème périorbitaire, prurit oculaire, conjonctivite, sécheresse oculaire.
- Peu fréquent : altération visuelle, vision trouble, diminution de l’acuité visuelle, oedème palpébral, photopsie, irritation oculaire.
- Fréquence indéterminée : oedème papillaire, choriorétinopathie, diplopie, photophobie, oedème oculaire, blépharite, douleurs oculaires, hémorragie conjonctivale, conjonctivite allergique, hyperémie conjonctivale, hyperémie oculaire, maladie de la surface oculaire, hyperémie sclérale.
- Fréquent : hémorragie oculaire, oedème périorbitaire, prurit oculaire, conjonctivite, sécheresse oculaire.
- Affections de l’oreille et du labyrinthe :
- Fréquent : vertiges.
- Fréquence indéterminée : troubles de l’audition, douleurs auriculaires, acouphènes.
- Fréquent : vertiges.
- Affections cardiaques :
- Fréquent : angor, arythmies (incluant bloc auriculoventriculaire, flutter, extrasystoles, tachycardie, fibrillations auriculaires, bradycardie), palpitations, allongement de l’intervalle QT à l’électrocardiogramme.
- Peu fréquent : insuffisance cardiaque, épanchement péricardique, maladie coronarienne, souffle cardiaque, cyanose.
- Fréquence indéterminée : infarctus du myocarde, dysfonction ventriculaire, péricardite, péricardite, diminution de la fraction d’éjection.
- Fréquent : angor, arythmies (incluant bloc auriculoventriculaire, flutter, extrasystoles, tachycardie, fibrillations auriculaires, bradycardie), palpitations, allongement de l’intervalle QT à l’électrocardiogramme.
- Affections vasculaires :
- Fréquent : hypertension, bouffées vasomotrices.
- Peu fréquent : crise hypertensive, hématomes.
- Fréquence indéterminée : choc hémorragique, hypotension, thrombose.
- Fréquent : hypertension, bouffées vasomotrices.
- Affections respiratoires, thoraciques et médiastinales :
- Fréquent : dyspnée, dyspnée d’effort, épistaxis, toux, dysphonie.
- Peu fréquent : oedème pulmonaire, épanchement pleural, pneumopathie interstitielle, douleur pleurale, pleurésie, douleur pharyngolaryngée, irritation de la gorge.
- Fréquence indéterminée : hypertension pulmonaire, sifflement respiratoire.
- Fréquent : dyspnée, dyspnée d’effort, épistaxis, toux, dysphonie.
- Affections gastro-intestinales :
- Fréquent : pancréatite, inconfort abdominal, distension abdominale, dyspepsie, flatulence.
- Peu fréquent : hémorragie gastro-intestinale, méléna, ulcérations buccales, reflux gastro-oesophagien, stomatite, douleurs oesophagiennes, dysgueusie, sécheresse buccale.
- Fréquence indéterminée : perforation d’un ulcère gastro-intestinal, hémorragie rétropéritonéale, hématémèse, ulcère gastrique, oesophagite ulcérative, occlusion intestinale basse, gastrite, hémorroïdes, hernie hiatale, hémorragie rectale, sensibilité dentaire, gingivite.
- Fréquent : pancréatite, inconfort abdominal, distension abdominale, dyspepsie, flatulence.
- Affections hépatobiliaires :
- Fréquent : fonction hépatique anormale.
- Peu fréquent : hépatite, ictère.
- Fréquence indéterminée : cholestase, hépatotoxicité, hépatomégalie.
- Fréquent : fonction hépatique anormale.
- Affections de la peau et du tissu sous-cutané :
- Fréquent : sueurs nocturnes, eczéma, urticaire, érythème, hyperhidrose, contusion, acné, dermatose, sécheresse cutanée.
- Peu fréquent : dermatite exfoliative, éruption médicamenteuse, douleurs cutanées, ecchymoses, oedème de la face.
- Fréquence indéterminée : érythème noueux, ulcérations cutanées, érythrodysesthésie palmoplantaire, pétéchies, photosensibilité, éruption bulleuse, kystes épidermoïdes, hyperplasie sébacée, atrophie cutanée, décoloration cutanée, desquamation cutanée, hyperpigmentation cutanée, hypertrophie cutanée.
- Fréquent : sueurs nocturnes, eczéma, urticaire, érythème, hyperhidrose, contusion, acné, dermatose, sécheresse cutanée.
- Affections musculosquelettiques et systémiques :
- Fréquent : douleur musculosquelettique au niveau du thorax, douleurs musculosquelettiques, douleurs des extrémités, douleurs dorsales.
- Peu fréquent : douleurs costales, raideur musculosquelettique, douleur, faiblesse musculaire, oedème articulaire.
- Fréquence indéterminée : arthrite.
- Fréquent : douleur musculosquelettique au niveau du thorax, douleurs musculosquelettiques, douleurs des extrémités, douleurs dorsales.
- Affections du rein et des voies urinaires :
- Fréquent : pollakiurie.
- Peu fréquent : dysurie, urgences mictionnelles, nycturie.
- Fréquence indéterminée : insuffisance rénale, hématurie, incontinence urinaire, chromaturie.
- Fréquent : pollakiurie.
- Affections des organes de reproduction et du sein :
- Peu fréquent : douleurs mammaires, gynécomastie, dysfonction érectile.
- Fréquence indéterminée : induration mammaire, ménorragie, oedème mamelonnaire.
- Peu fréquent : douleurs mammaires, gynécomastie, dysfonction érectile.
- Troubles généraux et anomalies au site d’administration :
- Fréquent : douleur thoracique, douleurs (incluant douleurs cervicales et dorsales), pyrexie, gêne thoracique, malaise.
- Peu fréquent : oedème de la face, oedème gravitationnel, syndrome grippal, frissons.
- Fréquence indéterminée : sensations de chaleur, oedème localisé.
- Fréquent : douleur thoracique, douleurs (incluant douleurs cervicales et dorsales), pyrexie, gêne thoracique, malaise.
- Investigations :
- Fréquent : diminution du taux plaquettaire, augmentation des taux sanguins d’amylase, augmentation des taux sanguins de phosphatase alcaline, augmentation des taux de gamma-glutamyltransférase, augmentation des taux de créatinine phosphokinase, perte de poids, gain de poids.
- Peu fréquent : diminution du taux d’hémoglobine, diminution du taux de neutrophiles, augmentation des taux sanguins de lactate déshydrogénase, diminution de la glycémie, augmentation de l’urémie, diminution de la phosphorémie.
- Fréquence indéterminée : augmentation de l’insulinémie, diminution des lipoprotéines de très faible densité, augmentation du taux sanguin de la parathormone, augmentation de la kaliémie, augmentation de la pression artérielle, diminution du taux des leucocytes.
- Fréquent : diminution du taux plaquettaire, augmentation des taux sanguins d’amylase, augmentation des taux sanguins de phosphatase alcaline, augmentation des taux de gamma-glutamyltransférase, augmentation des taux de créatinine phosphokinase, perte de poids, gain de poids.
-
- Tasigna 150 mg et 200 mg :
- Les anomalies hématologiques ou biologiques cliniquement pertinentes ou sévères sont présentées dans le tableau 3.
-
Tableau 3 : Anomalies biologiques de grades 3-4 LMC-PC nouvellement diagnostiquée : 300 mg 2 fois/jour
(Tasigna 150 mg et 200 mg)LMC-PC et LMC-PA en cas de résistance ou d’intolérance à l’imatinib : 400 mg 2 fois/jour
(Tasigna 200 mg)n = 279 (%) LMC-PC n = 321 (%) LMC-PA n = 137 (%) Paramètres hématologiques/myélosuppression : Neutropénie 12 31 42 Thrombopénie 10 30 42 Anémie 3 11 27 Paramètres biochimiques : Élévation de la créatininémie 0 1 < 1 Élévation des taux de lipase 6 18 18 Élévation des taux de SGOT (ASAT) 1 3 2 Élévation des taux de SGPT (ALAT) 4 4 4 Hypophosphatémie 5 17 15 Élévation de la bilirubinémie (totale) 4 7 9
- Mort subite :
- Des cas peu fréquents (0,1 à 1 %) de mort subite ont été rapportés au cours d’essais cliniques menés avec Tasigna et dans le cadre de programme d’usage compassionnel chez des patients atteints de LMC en phase chronique ou en phase accélérée résistants ou intolérants à l’imatinib ayant des antécédents de pathologie cardiaque ou des facteurs de risque cardiaques significatifs associés (cf Mises en garde et Précautions d’emploi).
SURDOSAGE |
PHARMACODYNAMIE |
Groupe pharmacothérapeutique : Inhibiteurs de la protéine kinase (code ATC : L01XE08).
Le nilotinib est un inhibiteur puissant de l’activité tyrosine kinase Abl de l’oncoprotéine Bcr-Abl, à la fois dans les lignées cellulaires et dans les cellules leucémiques primaires chromosome Philadelphie positives. La substance présente une forte affinité pour le site de liaison de l’ATP, ce qui en fait un inhibiteur puissant du Bcr-Abl de type sauvage, également actif contre 32 sur 33 formes mutantes du Bcr-Abl résistantes à l’imatinib. En raison de cette activité biochimique, le nilotinib inhibe de manière sélective la prolifération et induit l’apoptose au niveau des lignées cellulaires et des cellules leucémiques primaires chromosome Philadelphie positives, chez les patients atteints de LMC. Dans les modèles murins de LMC, en cas d’administration orale, le nilotinib en monothérapie réduit la charge tumorale et prolonge la survie.
Le nilotinib a peu ou pas d’effet contre la majorité des autres protéines kinases examinées (y compris Src), à l’exception des kinases des récepteurs PDGF, Kit et Éphrine qu’il inhibe à des concentrations comprises dans l’intervalle atteint après une administration orale aux doses thérapeutiques recommandées dans le traitement de la LMC (cf voir tableau 4).
| Bcr-Abl | PDGFR | Kit |
| 20 | 69 | 210 |
- Études cliniques dans la LMC en phase chronique nouvellement diagnostiquée :
- Une étude clinique en ouvert, multicentrique, randomisée de phase III a été menée pour évaluer l’efficacité du nilotinib versus imatinib chez 846 patients adultes atteints de LMC en phase chronique nouvellement diagnostiquée confirmée par analyse cytogénétique. Le diagnostic datait de moins de 6 mois et les patients n’étaient pas traités au préalable à l’exception des traitements par hydroxyurée et/ou anagrélide. Selon la randomisation 1 :1 :1, les patients recevaient soit 300 mg de nilotinib deux fois par jour (n = 282), soit 400 mg de nilotinib deux fois par jour (n = 281), soit 400 mg d’imatinib une fois par jour (n = 283). La randomisation était stratifiée sur le score de Sokal à la date du diagnostic.
- Les caractéristiques initiales étaient bien équilibrées dans les trois groupes de traitement. L’âge médian était de 47 ans dans les deux bras nilotinib et 46 ans dans le bras imatinib. Les proportions de patients âgés de 65 ans et plus étaient de 12,8 % dans le bras nilotinib à 300 mg deux fois par jour, 10,0 % dans le bras nilotinib à 400 mg deux fois par jour et 12,4 % dans le bras imatinib à 400 mg une fois par jour. Il y avait légèrement plus d’hommes que de femmes (56,0 %, 62,3 % et 55,8 %, respectivement, dans les bras nilotinib à 300 mg deux fois par jour et à 400 mg deux fois par jour, et dans le bras imatinib à 400 mg une fois par jour). Plus de 60 % des patients étaient blancs et 25 % des patients étaient asiatiques.
- La date de première analyse était prévue quand tous les 846 patients avaient atteint 12 mois de traitement (ou arrêté prématurément). La durée médiane de traitement était de 14 mois. Plus de 60 % des patients avaient reçu plus de 12 mois de traitement. La dose médiane réelle était de 592 mg/jour pour le nilotinib à 300 mg deux fois par jour, 779 mg/jour pour le nilotinib à 400 mg deux fois par jour et 400 mg/jour pour l’imatinib à 400 mg une fois par jour.
- Le critère primaire d’efficacité était la réponse moléculaire majeure (RMM) à 12 mois. La RMM était définie comme une valeur du ratio de Bcr-Abl/Abl <= 0,1 % mesurée en RQ-PCR selon l’échelle internationale, ce qui correspond à une réduction >= 3 log du transcrit Bcr-Abl par rapport au taux de base standardisé. Le taux de RMM à 12 mois était significativement supérieur pour le nilotinib à 300 mg deux fois par jour par rapport à l’imatinib 400 mg une fois par jour (44,3 % versus 22,3 %, p < 0,0001). Le taux de RMM à 12 mois était également significativement supérieur pour le nilotinib à 400 mg deux fois par jour par comparaison à l’imatinib 400 mg une fois par jour (42,7 % versus 22,3 %, p < 0,0001).
- Les taux de RMM à 3, 6, 9 et 12 mois étaient de 8,9 %, 33 %, 43,3 % et 44,3 % pour le nilotinib à 300 mg deux fois par jour, 5,0 %, 29,5 %, 38,1 % et 42,7 % pour le nilotinib à 400 mg deux fois par jour et 0,7 %, 12,0 %, 18,0 % et 22,3 % pour l’imatinib à 400 mg une fois par jour.
- L’analyse Kaplan-Meier du délai jusqu’à la première RMM est détaillée dans la figure 1. La probabilité d’atteindre une RMM à différents temps est plus élevée dans les deux bras nilotinib à 300 mg deux fois par jour et à 400 mg deux fois par jour que dans le bras imatinib à 400 mg une fois par jour (HR = 2,6 et test de log-rank stratifié p < 0,0001 entre le nilotinib à 300 mg deux fois par jour et l’imatinib à 400 mg une fois par jour, HR = 1,6 et test de log-rank stratifié p < 0,0001 entre le nilotinib à 400 mg deux fois par jour et l’imatinib à 400 mg une fois par jour). La proportion de patients ayant atteint un ratio Bcr-Abl <= 0,01 % (une réduction de 4 log) et <= 0,0032 % (une réduction de 4,5 log) à 12 mois était significativement plus élevée pour les bras nilotinib à 300 mg deux fois par jour (respectivement 11,7 % et 4,3 %) et nilotinib à 400 mg deux fois par jour (respectivement 8,5 % et 4,6 %) que dans le bras imatinib à 400 mg une fois par jour (respectivement 3,9 % et 0,4 %). Quel que soit le score de Sokal, les taux de réponses étaient plus élevés pour les deux bras nilotinib à 300 mg et nilotinib à 400 mg deux fois par jour que dans le bras imatinib à 400 mg une fois par jour.
-
Tableau 5 : Taux de réponse moléculaire majeure (RMM) à 12 mois Tasigna (nilotinib) AMN107 300 mg 2 fois/jour
n = 282
(%)Tasigna (nilotinib) AMN107 400 mg 2 fois/jour
n = 281
(%)Glivec (imatinib) STI571 400 mg 1 fois/jour
n = 283
(%)Réponse (IC 95%) 44,3 (38,4 ; 50,3) 42,7 (36,8 ; 48,7) 22,3 (17,6 ; 27,6) Absence de réponse 55,7 57,3 77,7 Valeur du p pour taux de réponse selon test de CMH* (vs imatinib 400 mg 1 fois/jour) < 0,0001 < 0,0001 -
*
CMH = Cochran-Mantel-Haenszel.
-
Figure 1 : Courbe Kaplan-Meier, délai estimé jusqu’à la première réponse moléculaire majeure (MMR) 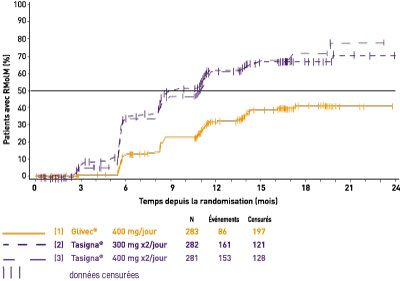
-
Événements à risque (mois) 0 3 6 9 12 15 18 21 24 (1) 283 : 0 260 : 2 221 : 33 188 : 57 110 : 75 64 : 84 33 : 86 12 : 86 0 : 86 (2) 282 : 0 241 : 22 164 : 93 118 : 131 62 : 154 32 : 159 14 : 160 6 : 161 0 : 161 (3) 281 : 0 244 : 13 168 : 82 128 : 116 59 : 144 27 : 151 7 : 152 2 : 153 0 : 153 - La réponse cytogénétique complète (RCyC) était définie comme étant 0 % de métaphase Ph+ dans la moelle osseuse évaluée sur un minimum de 20 métaphases. Le meilleur taux de RCyC à 12 mois (les patients ayant atteint une RCyC à 12 mois ou plus tôt étaient considérés répondeurs) était significativement plus élevé dans les deux bras nilotinib à 300 mg et nilotinib à 400 mg deux fois par jour que dans le bras imatinib à 400 mg une fois par jour.
-
Tableau 6 : Meilleur taux de réponse cytogénétique complète à 12 mois Tasigna (nilotinib) 300 mg 2 fois/jour
n = 282
(%)Tasigna (nilotinib) 400 mg 2 fois/jour
n = 281
(%)Glivec (imatinib) 400 mg 1 fois/jour
n = 283
(%)Réponse (IC 95%) 80,1 (75,0 ; 84,6) 77,9 (72,6 ; 82,6) 65,0 (59,2 ; 70,6) Absence de réponse 19,9 22,1 35,0 Valeur du p pour taux de réponse selon test de CMH* (vs imatinib 400 mg 1 fois/jour) < 0,0001 0,0005 -
*
CMH = Cochran-Mantel-Haenszel.
- La progression vers la phase accélérée ou la crise blastique sous traitement a été observée chez 14 patients : 2 patients traités par nilotinib à 300 mg deux fois par jour, 1 patient traité par nilotinib à 400 mg deux fois par jour et 11 patients traités par l’imatinib à 400 mg une fois par jour. Aucun de ces patients ayant progressé n’avait atteint une RMM, tandis que 3 de ces patients ayant reçu l’imatinib à 400 mg une fois par jour avaient atteint une RCyC. En terme de progression vers la phase accélérée et la crise blastique, la différence est statistiquement significative, en faveur du nilotinib, entre le bras nilotinib à 300 mg deux fois par jour et le bras imatinib à 400 mg une fois par jour (p = 0,0095) et entre le bras nilotinib à 400 mg deux fois par jour et le bras imatinib à 400 mg une fois par jour (p = 0,0037).
- Études cliniques dans la LMC en phase chronique et en phase accélérée en cas de résistance ou intolérance à l’imatinib (Tasigna 200 mg) :
- Une étude clinique en ouvert de phase II, multicentrique et non contrôlée, a été menée afin de déterminer l’efficacité de Tasigna chez des patients atteints de LMC et présentant une résistance ou une intolérance à l’imatinib ; les patients en phase chronique et les patients en phase accélérée ont été répartis dans des bras de traitement séparés. L’étude est toujours en cours. L’efficacité a été évaluée sur 321 patients en PC et 137 patients en PA inclus dans l’étude. La durée médiane de traitement était de 561 jours pour les patients en PC et de 264 jours pour les patients en PA (cf voir tableau 7). Tasigna a été administré en continu (deux fois par jour, 2 heures après un repas et sans prise alimentaire pendant au moins l’heure suivant l’administration), sauf en cas de signes évidents d’une réponse insuffisante ou d’une progression de la maladie. La dose était de 400 mg deux fois par jour et une augmentation de la posologie à 600 mg deux fois par jour était autorisée.
-
Tableau 7 : Durée de l’exposition à Tasigna Phase chronique (n = 321) Phase accélérée (n = 137) Durée médiane de traitement (jours) 561 264 (25e-75e percentiles) (196-852) (1115-595) - La résistance à l’imatinib était définie comme étant l’absence d’une réponse hématologique complète (après 3 mois), d’une réponse cytogénétique (après 6 mois) ou d’une réponse cytogénétique majeure (après 12 mois) ou comme étant une progression de la maladie après une réponse cytogénétique ou hématologique antérieure. Les patients intolérants à l’imatinib étaient définis comme étant les patients ayant interrompu le traitement par l’imatinib en raison d’une toxicité et ne présentant aucune réponse cytogénétique majeure au moment de l’inclusion dans l’étude.
- Au total, 73 % des patients étaient résistants à l’imatinib, tandis que 27 % étaient intolérants à l’imatinib. La majorité des patients avaient une longue histoire de LMC, incluant un traitement antérieur intensif par d’autres agents antinéoplasiques, dont l’imatinib, l’hydroxyurée et l’interféron, et certains patients étaient même en échec d’une greffe de moelle osseuse (cf voir tableau 8). La dose maximale antérieure médiane d’imatinib avait été de 600 mg/jour. La dose maximale antérieure d’imatinib était >= 600 mg/jour chez 74 % de tous les patients, avec 40 % des patients recevant des doses d’imatinib >= 800 mg/jour.
-
Tableau 8 : Caractéristiques de l’histoire de la LMC Phase chronique (n = 321) Phase accélérée (n = 137)* Délai médian depuis le diagnostic (mois) 58 71 (intervalle) (5-275) (2-298) Imatinib – Patients résistants
226 (70 %) 109 (80 %) – Patients intolérants sans RCyM
95 (30 %) 27 (20 %) Durée médiane du traitement par imatinib (jours) 975 857 (25e-75e percentiles) (519-1488) (424-1497) Traitement antérieur par hydroxyurée 83 % 91 % Traitement antérieur par interféron 58 % 50 % Greffe de moelle osseuse antérieure 7 % 8 % -
*
Information manquante sur le statut de résistance/intolérance à l’imatinib pour un patient.
- Chez les patients en PC, le critère d’évaluation primaire était la réponse cytogénétique majeure (RCyM), définie comme étant l’élimination (réponse cytogénétique complète, RCyC) ou la réduction significative à moins de 35 % de métaphases Ph+ (réponse cytogénétique partielle) des cellules hématopoïétiques Ph+. Chez les patients en PC, la réponse hématologique complète (RHC) était un critère d’évaluation secondaire. Chez les patients en PA, le critère d’évaluation primaire était la réponse hématologique (RH) globale confirmée, définie comme étant une réponse hématologique complète, l’absence de signes de leucémie ou le retour en phase chronique.
-
- – Phase chronique :
- Chez les 321 patients en PC, le taux de RCyM était de 51 %. Dans la plupart des cas, la RCyM survenait rapidement, dans les 3 mois (médiane : 2,8 mois) suivant le début du traitement par Tasigna et cette réponse se maintenait. Le délai médian d’obtention de la RCyC était juste au-delà de 3 mois (médiane : 3,4 mois). Parmi les patients ayant obtenu une RCyM, 77 % (95 % CI : 70 %-84 %) conservaient cette réponse à 24 mois. La durée médiane de la RCyM n’a pas été atteinte. Parmi les patients ayant obtenu une RCyC, 85 % (95 % CI : 78 %-93 %) conservaient cette réponse à 24 mois. La durée médiane de la RCyC n’a pas été atteinte. Les patients ayant une RHC à l’état initial obtenaient plus rapidement une RCyM (1,9 mois versus 2,8 mois). Parmi les patients en PC ne présentant aucune RHC à l’état initial, 70 % ont obtenu une RHC et le délai médian d’obtention de cette RHC était de 1 mois ; la durée médiane de la RHC était de 32,8 mois. Le taux estimé de survie globale à 24 mois était de 87 % chez les patients atteints de LMC-PC.
- – Phase chronique :
-
- – Phase accélérée :
- Chez les 137 patients en PA, le taux de RH globale confirmée était de 50 %. Dans la plupart des cas, la RH survenait rapidement avec le traitement par Tasigna (médiane : 1 mois), et cette réponse était durable (la durée médiane de RH confirmée était de 24,2 mois). Parmi les patients ayant obtenu une RH, 53 % (95 % CI : 39 %-67 %) conservaient cette réponse à 24 mois. Le taux de RCyM était de 30 % et le délai médian d’obtention de la réponse était de 2,8 mois. Parmi les patients ayant obtenu une RCyM, 63 % (95 % CI : 45 %-80 %) conservaient cette réponse à 24 mois. La durée médiane de RCyM était de 32,7 mois. Le taux estimé de survie globale à 24 mois était de 70 % chez les patients atteints de LMC-PA.
- – Phase accélérée :
- Le tableau 9 présente les taux de réponse pour les deux bras de traitement.
-
Tableau 9 : Réponse dans la LMC (Meilleur taux de réponse) Phase chronique Intolérants (n = 95) Résistants (n = 226) Total (n = 321) Réponse hématologique (%) : Globale (IC à 95 %) – – – Complète 87 (74-94) 65 (56-72) 70(1) (63-76) ASL(2) – – – Retour en PC – – – Réponse cytogénétique (%) : Majeure (IC à 95 %) 57 (46-67) 49 (42-56) 51 (46-57) Complète 41 35 37 Partielle 16 14 15 -
(Meilleur taux de réponse) Phase accélérée Intolérants (n = 27) Résistants (n = 109) Total(3) (n = 137) Réponse hématologique (%) : Globale (IC à 95 %) 48 (29-68) 51 (42-61) 50 (42-59) Complète 37 28 30 ASL(2) 7 10 9 Retour en PC 4 13 11 Réponse cytogénétique (%) : Majeure (IC à 95 %) 33 (17-54) 29 (21-39) 30 (22-38) Complète 22 19 20 Partielle 11 10 10 -
(1)
114 patients en PC présentaient une RHC à l’état initial et n’étaient donc pas évaluables concernant la réponse hématologique complète.
-
(2)
ASL = absence de signe de leucémie/réponse médullaire.
-
(3)
Information manquante sur le statut de résistance/intolérance à l’imatinib pour un patient.
- Les données d’efficacité chez les patients présentant une LMC en crise blastique ne sont pas encore disponibles. On a également inclus des bras de traitement séparés dans l’étude de phase II, afin d’évaluer Tasigna dans un groupe de patients en PC et en PA ayant reçu un traitement antérieur intensif par diverses thérapies, incluant un inhibiteur de la tyrosine kinase associé à l’imatinib. L’étude est toujours en cours. Parmi ces patients, 30 sur 36 (83 %) étaient résistants mais non intolérants au traitement. Chez les 22 patients en PC évalués concernant l’efficacité, Tasigna a induit un taux de RCyM de 32 % et un taux de RHC de 50 %. Chez les 11 patients en PA évalués concernant l’efficacité, le traitement a induit un taux de RH globale de 36 %.
- Après l’échec du traitement par imatinib, on a observé 24 mutations Bcr-Abl différentes chez 42 % des patients en phase chronique et chez 54 % des patients en phase accélérée, évalués concernant les mutations. Tasigna s’est révélé efficace chez les patients porteurs de diverses mutations du Bcr-Abl associées à une résistance à l’imatinib, excepté pour la T315I.
- Population pédiatrique :
- L’Agence européenne du médicament a différé l’obligation de soumettre les résultats d’études réalisées avec Tasigna dans la population pédiatrique (de la naissance jusqu’à 18 ans) dans le traitement de la leucémie myéloïde chronique chromosome Philadelphie positive (cf Posologie et Mode d’administration pour les informations concernant l’usage pédiatrique).
PHARMACOCINÉTIQUE |
- Absorption :
- Les concentrations maximales du nilotinib sont atteintes 3 heures après une administration orale. Après administration orale, l’absorption du nilotinib est d’environ 30 %. Chez des volontaires sains, en cas de prise alimentaire concomitante, la Cmax et l’aire sous la courbe concentration sériques-temps (ASC) du nilotinib augmentent respectivement de 112 % et 82 %, par rapport à une administration à jeun. L’administration de Tasigna 30 minutes ou 2 heures après la prise d’aliments augmente la biodisponibilité du nilotinib de respectivement 29 % et 15 % (cf Posologie et Mode d’administration, Mises en garde et Précautions d’emploi, Interactions).
- Une bioéquivalence a été démontrée entre l’administration unique d’une dose de 400 mg de nilotinib en utilisant deux gélules à 200 mg dont le contenu était dispersé dans une cuillère à café de compote de pommes et l’administration unique de 2 gélules intactes à 200 mg.
- L’absorption du nilotinib (biodisponibilité relative) peut être réduite respectivement d’environ 48 % chez des patients ayant une gastrectomie totale et de 22 % chez des patients ayant une gastrectomie partielle.
- Distribution :
- Le rapport des concentrations sang/plasma du nilotinib est de 0,71. Le taux de liaison aux protéines plasmatiques est d’environ 98 %, sur base des études in vitro.
- Biotransformation :
- Les principales voies métaboliques identifiées chez les sujets sains sont l’oxydation et l’hydroxylation. Le nilotinib est le principal composant circulant dans le sérum. Aucun des métabolites ne contribue de manière significative à l’activité pharmacologique du nilotinib. Le nilotinib est essentiellement métabolisé par le CYP3A4, avec une éventuelle contribution mineure du CYP2C8.
- Élimination :
- Après l’administration d’une dose unique de nilotinib marqué de manière radioactive chez des sujets sains, plus de 90 % de la dose s’éliminaient dans les 7 jours, principalement dans les selles (94 % de la dose). La molécule mère représentait 69 % de la dose.
- Linéarité/non-linéarité :
- A l’état d’équilibre, l’exposition au nilotinib dépend de la dose. En cas d’une seule administration quotidienne de doses supérieures à 400 mg, les augmentations de l’exposition systémique étaient inférieures aux valeurs proportionnelles à la dose. En cas d’administration d’une dose de 400 mg deux fois par jour, l’exposition sérique quotidienne au nilotinib augmentait de 35 % à l’état d’équilibre, par rapport à l’exposition observée en cas d’une seule administration quotidienne d’une dose de 800 mg. L’exposition systémique (ASC) au nilotinib à l’état d’équilibre à une dose de 400 mg deux fois par jour était environ 13,4 % plus élevée qu’une dose de 300 mg deux fois par jour. La moyenne des valeurs hautes et basses de la concentration sur 12 mois étaient environ 15,7 % et 14,8 % plus élevée avec 400 mg deux fois par jour comparé à 300 mg deux fois par jour. On n’observait aucune augmentation significative de l’exposition au nilotinib lorsqu’on augmentait la posologie de 400 mg deux fois par jour à 600 mg deux fois par jour.
- Caractéristiques des patients :
- Les conditions d’équilibre sont généralement atteintes dans les 8 jours. Entre la prise de la première dose et l’état d’équilibre, l’exposition sérique au nilotinib augmentait d’environ 2 fois en cas d’une seule prise quotidienne, et d’environ 3,8 fois en cas de deux prises quotidiennes. La demi-vie d’élimination apparente, estimée à partir de la pharmacocinétique à doses répétées avec une prise quotidienne, était d’environ 17 heures. La variabilité interindividuelle de la pharmacocinétique du nilotinib était modérée à élevée.
SÉCURITE PRÉCLINIQUE |
Le nilotinib a été évalué dans des études de pharmacologie de sécurité, de toxicologie en administration répétée, de génotoxicité, de toxicité sur la reproduction et de phototoxicité.
Le nilotinib n’a exercé aucun effet sur le SNC ou les fonctions respiratoires. Les études de toxicité cardiaque in vitro ont révélé un signal préclinique d’allongement de l’intervalle QT, se traduisant par un bloc des courants hERG et un allongement de la durée du potentiel d’action, induits par le nilotinib sur des coeurs de lapin isolés. Chez des chiens ou des singes traités au cours de périodes allant jusqu’à 39 semaines, et dans une étude spécifique de télémétrie réalisée chez des chiens, aucun effet n’a été observé sur les paramètres de l’ECG.
Des études de toxicité en administration répétée jusqu’à 4 semaines chez le chien et jusqu’à 9 mois chez le singe macaque, ont montré que le foie est le principal organe cible de la toxicité du nilotinib. Les altérations incluaient une élévation des activités de l’alanine aminotransférase et de la phosphatase alcaline, ainsi que des anomalies histopathologiques (essentiellement une hyperplasie/hypertrophie des cellules sinusoïdales ou des cellules de Kupffer, une hyperplasie des canaux biliaires et une fibrose périportale). En général, les modifications de biochimie étaient totalement réversibles après une période de récupération de quatre semaines, et les modifications histologiques étaient partiellement réversibles. Les expositions aux doses les plus faibles induisant des effets hépatiques étaient inférieures à l’exposition observée chez l’homme en cas d’administration d’une dose de 800 mg/jour. Chez des souris et des rats traités durant jusqu’à 26 semaines, on n’a observé que des altérations hépatiques mineures. Chez le rat, le chien et le singe, on a observé des augmentations le plus souvent réversibles des taux de cholestérol.
Les études de génotoxicité menées sur des systèmes bactériens in vitro et des systèmes mammifères in vitro et in vivo, avec et sans activation métabolique, n’ont montré aucun signe de potentiel mutagène du nilotinib.
Le nilotinib n’induisait aucune tératogénicité, mais s’est montré toxique pour l’embryon et le foetus à des doses entraînant également une toxicité maternelle. Lors de l’étude de fertilité réalisée chez les mâles et les femelles, ainsi qu’au cours de l’étude d’embryotoxicité uniquement réalisée chez les femelles, on a observé une augmentation des pertes postimplantation. Au cours des études d’embryotoxicité, on a observé une létalité embryonnaire et des effets sur le foetus (principalement une réduction du poids des foetus, une fusion prématurée des os de la face [fusion maxillaire/zygomatique] et des anomalies viscérales et squelettiques) chez le rat, ainsi qu’une augmentation de la résorption des foetus et des anomalies squelettiques chez le lapin. Dans une étude de développement pré- et postnatal menée chez le rat, l’exposition maternelle au nilotinib a entraîné chez la progéniture une réduction du poids corporel associée à des modifications des paramètres du développement physique ainsi que des indices d’accouplement et de fertilité. Chez les femelles, l’exposition au nilotinib, aux doses n’induisant aucun effet indésirable, était généralement inférieure ou égale à l’exposition observée chez l’homme à une dose de 800 mg/jour.
Dans une étude de développement menée chez l’animal juvénile, le nilotinib a été administré par voie orale à des rats juvéniles dès la première semaine post-partum jusqu’à l’âge adulte jeune (70 jours post-partum) à des doses de 2, 6 et 20 mg/kg/jour. Au-delà des paramètres standards d’étude, les évaluations des organes de repère pour le développement, les effets sur le SNC, sur l’accouplement et la fertilité ont été évalués. Basé sur la réduction du poids corporel chez les deux sexes et un retard à la séparation prépuciale chez les mâles (qui peut être associé à une perte de poids), la dose sans effet observable chez les rats juvéniles a été évaluée à 6 mg/kg/jour. Les animaux juvéniles n’ont pas présenté une augmentation de la sensibilité au nilotinib par rapport aux animaux adultes. De plus, le profil de toxicité des rats juvéniles était comparable à celui observé chez les rats adultes.
Chez les rats mâles et femelles, en cas d’administration de la dose maximale testée (environ 5 fois supérieure à la posologie recommandée chez l’être humain), aucun effet n’a été observé sur le nombre/la mobilité des spermatozoïdes ou sur la fertilité.
Le nilotinib absorbe la lumière dans la gamme UVB et UVA. Il est distribué dans la peau et présente un potentiel phototoxique in vitro, mais on n’a observé aucun effet in vivo. Chez les patients, on considère donc que le risque de photosensibilisation par le nilotinib est très faible. Il n’a pas été mené d’études de carcinogénicité avec le nilotinib.
MODALITÉS DE CONSERVATION |
- Durée de conservation :
-
- Gélule à 150 mg : 2 ans.
- Gélule à 200 mg : 3 ans.
- Gélule à 150 mg : 2 ans.
A conserver à une température ne dépassant pas 30 °C, dans l’emballage extérieur d’origine, à l’abri de l’humidité.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| Médicament soumis à prescription initiale hospitalière semestrielle. | |
| Prescription initiale et renouvellement réservés aux spécialistes en oncologie ou en hématologie, ou aux médecins compétents en cancérologie. | |
| Médicament nécessitant une surveillance particulière pendant le traitement. | |
| AMM | EU/1/07/422/005 ; CIP 3400949815845 (2010) 28 gél à 150 mg. |
| EU/1/07/422/006 ; CIP 3400949815906 (2010) 112 gél à 150 mg. | |
| EU/1/07/422/002 ; CIP 3400938278699 (RCP rév 20.12.2010) 28 gél à 200 mg. | |
| EU/1/07/422/004 ; CIP 3400938278811 (RCP rév 20.12.2010) 112 gél à 200 mg. | |
| Prix : | 1043.64 euros (28 gélules à 200 mg). |
| 4097.65 euros (112 gélules à 200 mg). | |
| Gélule à 150 mg : Non remboursable et non agréé Collect à la date du 01.03.2011 (demandes à l’étude). | |
| Gélule à 200 mg : Remb Séc soc à 100 %. Collect. | |
|
Non remboursable à la date du 01.03.11 dans le traitement de la leucémie myéloïde chronique (LMC) chromosome Philadelphie positive en phase chronique, nouvellement diagnostiquée (demande d’admission à l’étude). |
|
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne du médicament http://www.ema.europa.eu.
Titulaire de l’AMM : Novartis Europharm Limited, Wimblehurst road, Horsham, West Sussex, RH12 5AB, Royaume-Uni.
Novartis Pharma SAS
2-4, rue Lionel-Terray. 92500 Rueil-Malmaison
Tél : 01 55 47 60 00
Information et Communication Médicales :
Tél : 01 55 47 66 00 E-mail : icm.phfr@novartis.com
Site web : http://www.novartis.fr
Liste Des Sections Les Plus Importantes :
- pathologies
- Medicaments
- Medicaments injectables
- Traitement D’Urgence
- Guide Infirmier Des Examens De Laboratoire
- Infirmiers En Urgences
- Fiche Technique Medical
- Techniques De Manipulations En Radiologie Medicale
- Bibliotheque_medicale



