romiplostim
FORMES et PRÉSENTATIONS |
COMPOSITION |
| Poudre pour solution injectable à 250 µg ou à 500 µg : | p flacon |
| Romiplostim* (DCI) | 250 µg |
| ou | 500 µg |
Solvant : eau ppi.
Poudre à 250 µg : Après reconstitution, un volume injectable de 0,5 ml de solution contient 250 µg de romiplostim (500 µg/ml). Chaque flacon contient un surremplissage permettant la délivrance de 250 µg de romiplostim.
Poudre à 500 µg : Après reconstitution, un volume injectable de 1 ml de solution contient 500 µg de romiplostim (500 µg/ml). Chaque flacon contient un surremplissage permettant la délivrance de 500 µg de romiplostim.
* Le romiplostim est produit par la technique de l’ADN recombinant dans des cellules d’Escherichia coli.
INDICATIONS |
- Nplate est indiqué chez l’adulte splénectomisé présentant un purpura thrombopénique auto-immun (PTI) [idiopathique] chronique, réfractaire aux autres traitements (par exemple corticoïdes, immunoglobulines).
- Nplate peut être envisagé comme traitement de seconde intention chez l’adulte non splénectomisé quand la chirurgie est contre-indiquée.
POSOLOGIE ET MODE D’ADMINISTRATION |
Nplate doit être administré une fois par semaine en injection sous-cutanée.
- Posologie initiale :
- La posologie initiale de romiplostim est de 1 µg/kg de poids corporel.
-
Calcul de la posologie : Posologie initiale ou posologie hebdomadaire suivante :
Poids* en kg x Dose en µg/kg = Posologie individuelle en µgVolume à administrer :
Posologie en µg x 1 ml/500 µg = Volume à injecter en mlExemple : un patient de 75 kg à la posologie initiale de 1 µg/kg de romiplostim
– posologie individuelle = 75 kg x 1 µg/kg = 75 µg- volume correspondant de solution de Nplate à injecter = 75 µg x 1 ml/500 µg = 0,15 ml
-
*
Le poids corporel au moment de l’initiation du traitement doit toujours être utilisé pour le calcul de la posologie de romiplostim. Les ajustements de posologie sont basés uniquement sur l’évolution des taux de plaquettes et sont effectués par palier de 1 µg/kg (cf tableau ci-après).
- Ajustement de posologie :
- Le poids corporel du patient mesuré à l’initiation du traitement doit toujours être utilisé pour le calcul de la dose. La dose hebdomadaire de romiplostim doit être augmentée par palier de 1 µg/kg jusqu’à ce que le patient atteigne un taux de plaquettes >= 50 x 109/l. Le taux de plaquettes doit être évalué toutes les semaines jusqu’à atteindre un taux stable (>= 50 x 109/l pendant au moins 4 semaines à la même posologie). Ensuite le taux de plaquettes doit être évalué mensuellement. Ne pas dépasser la posologie maximale hebdomadaire de 10 µg/kg.
-
L’ajustement de posologie se fait de la façon suivante : Taux de plaquettes (x 109/l) Action < 50 Augmenter la dose hebdomadaire de 1 µg/kg > 150 pendant 2 semaines consécutives Diminuer la dose hebdomadaire de 1 µg/kg > 250 Interrompre le traitement, continuer à évaluer le taux de plaquettes de façon hebdomadaire. - Quand le taux de plaquettes redevient < 150 x 109/l, reprendre le traitement hebdomadaire avec la dernière posologie en la diminuant de 1 µg/kg
- En raison de la variabilité interindividuelle de la réponse plaquettaire, le taux de plaquettes chez certains patients peut chuter brusquement en dessous de 50 × 109/l après une réduction de dose ou une interruption de traitement. Dans ces cas, si la situation clinique est appropriée et suivant l’avis médical, des taux limites de plaquettes supérieurs peuvent être considérés pour réduire la dose (200 × 109/l) et pour interrompre le traitement (400 × 109/l).
- Une perte de réponse ou l’échec de maintien d’une réponse plaquettaire avec le romiplostim aux posologies recommandées doit en faire rechercher rapidement l’origine (cf Mises en garde et Précautions d’emploi : Perte de réponse au romiplostim).
- Arrêt du traitement :
- Le traitement par romiplostim doit être interrompu si, après 4 semaines de traitement à la posologie hebdomadaire maximale de 10 µg/kg le taux de plaquettes n’augmente pas jusqu’à un niveau suffisant permettant d’éviter des hémorragies cliniquement importantes.
- Les patients doivent être suivis régulièrement et la poursuite du traitement doit être envisagée par le médecin pour chaque patient. La réapparition d’une thrombopénie est possible à l’interruption du traitement (cf Mises en garde et Précautions d’emploi).
- Patients âgés (>= 65 ans) :
- Aucune différence de tolérance ou d’efficacité n’a été observée entre les patients < 65 ans et les patients >= 65 ans (cf Pharmacodynamie). Ainsi, aucun ajustement de posologie n’est nécessaire chez le patient âgé. Il est toutefois recommandé une surveillance particulière de ces patients en raison du faible nombre d’inclusions dans les essais cliniques effectués jusqu’à présent.
- Population pédiatrique :
- En l’absence de données suffisantes sur l’efficacité et la tolérance, l’utilisation de Nplate n’est pas recommandée chez les enfants de moins de 18 ans. Aucune recommandation sur la posologie dans cette population ne peut être donnée.
- Insuffisance hépatique :
- Le romiplostim ne doit pas être utilisé chez les patients présentant une insuffisance hépatique modérée à sévère (score de Child-Pugh >= 7), sauf si le bénéfice attendu l’emporte sur le risque identifié de thrombose de la veine porte chez les patients présentant une thrombopénie, associée à une insuffisance hépatique, traitée par agonistes de la TPO ( cf Mises en garde et Précautions d’emploi).
- Si l’utilisation du romiplostim est jugée nécessaire, le taux de plaquettes doit être étroitement surveillé afin de minimiser le risque de complications thromboemboliques.
- Insuffisance rénale :
- Aucune étude clinique spécifique n’a été réalisée dans ces populations. Nplate doit être utilisé avec précaution chez ces patients.
Mode d’administration :
Administration sous-cutanée.
Après reconstitution, Nplate solution injectable s’administre par voie sous-cutanée. Le volume à injecter peut être très faible. Une seringue avec des graduations de 0,01 ml doit être utilisée.
Pour les instructions de reconstitution de Nplate avant administration, cf Modalités de manipulation et d’élimination.
CONTRE-INDICATIONS |
MISES EN GARDE et PRÉCAUTIONS D’EMPLOI |
- Réapparition de la thrombopénie et saignements après l’interruption du traitement :
- La thrombopénie est susceptible de réapparaître à l’arrêt du traitement par romiplostim. Le risque de saignement augmente si le traitement par romiplostim est interrompu alors qu’un traitement par anticoagulant ou antiagrégant plaquettaire est en cours. Les patients doivent être étroitement surveillés pour déceler toute diminution du taux de plaquettes et pris en charge médicalement pour éviter tout saignement à l’arrêt du traitement par romiplostim. En cas d’interruption du traitement par romiplostim, il est recommandé de reprendre le traitement du PTI selon les recommandations habituelles de prise en charge. Une prise en charge médicale supplémentaire peut comprendre l’arrêt des anticoagulants et/ou des antiagrégants plaquettaires, des antidotes aux anticoagulants ou des transfusions de plaquettes.
- Augmentation de la réticuline de la moelle osseuse :
- L’augmentation de réticuline dans la moelle osseuse est probablement le résultat de la stimulation du récepteur à la TPO entraînant une augmentation du nombre de mégacaryocytes qui pourraient induire une production de cytokines. L’augmentation de la réticuline peut être évoquée lors de modifications morphologiques des cellules sanguines périphériques et peut être détectée par une biopsie de moelle osseuse. Il est donc recommandé de rechercher les anomalies cytologiques sur frottis sanguin et d’effectuer des numérations de la formule sanguine (NFS) avant et pendant le traitement par romiplostim. Cf Effets indésirables pour les informations sur l’augmentation de réticuline dans les essais cliniques avec romiplostim.
- Si une perte d’efficacité et des anomalies cytologiques sont observées sur les frottis sanguins, l’administration du romiplostim doit être interrompue, un examen clinique doit être effectué et une biopsie de la moelle osseuse avec une coloration de la réticuline appropriée doit être envisagée. La comparaison avec une précédente biopsie de moelle osseuse, si disponible, doit être effectuée. Si l’efficacité se maintient et que le frottis de sang périphérique est anormal, le médecin devra évaluer toutes les options cliniques, notamment la réalisation d’une biopsie de moelle osseuse, la réévaluation du rapport bénéfice/risque de la poursuite du traitement par romiplostim ou l’instauration d’un autre traitement du PTI.
- Complications thrombotiques/thromboemboliques :
- Un taux de plaquettes supérieur aux valeurs normales expose à un risque de complications thromboemboliques. L’incidence des événements thromboemboliques observés dans les études cliniques était similaire entre le romiplostim et le placebo. Aucun lien entre ces événements et un taux élevé de plaquettes n’a été mis en évidence. Des précautions sont nécessaires en cas d’administration du romiplostim chez des patients ayant des facteurs de risque connus de thromboembolie incluant, entre autres, des facteurs de risque héréditaires (par exemple Facteur V de Leiden) ou des facteurs de risque acquis (par exemple déficience d’ATIII, syndrome antiphospholipidique), un âge avancé, des patients ayant des périodes prolongées d’immobilisation, des pathologies malignes, des traitements contraceptifs ou hormono-substitutifs, une chirurgie ou un traumatisme, une obésité et un tabagisme.
- Chez des patients atteints de maladie hépatique chronique traités par romiplostim, des cas d’événements thromboemboliques, incluant des thromboses de la veine porte, ont été rapportés. Le romiplostim doit être utilisé avec précaution chez ces patients. Les recommandations d’ajustements de posologie doivent être suivies (cf Posologie et Mode d’administration).
- Progression d’hémopathies malignes existantes ou syndromes myélodysplasiques (SMD) :
- Les activateurs du récepteur à la TPO sont des facteurs de croissance qui entraînent la prolifération des cellules progénitrices thrombopoïétiques, la différenciation et la production de plaquettes. Le récepteur à la TPO est principalement exprimé sur la surface des cellules de la lignée myéloïde. En ce qui concerne les activateurs du récepteur à la TPO, il existe un risque théorique de progression d’hémopathies malignes dont les syndromes myélodysplasiques (SMD).
- Chez les adultes et les patients âgés, le diagnostic de PTI doit avoir été confirmé par l’exclusion d’autres situations cliniques pouvant induire une thrombopénie. La réalisation d’une ponction et d’une biopsie de la moelle osseuse tout au long de la maladie et du traitement doit être envisagée, particulièrement chez les patients âgés de plus de 60 ans, et ceux présentant des symptômes systémiques ou des signes anormaux.
- En dehors des essais cliniques, le romiplostim ne doit pas être utilisé pour le traitement de la thrombopénie liée aux SMD ou à toute autre cause autre que le PTI. Le rapport bénéfice/risque du romiplostim n’a pas été établi dans les SMD ni dans des pathologies autres que le PTI. Au cours d’études cliniques évaluant le romiplostim chez des patients présentant un SMD, des cas de progression vers une leucémie aiguë myéloïde (LAM) ont été observés. Cependant, ceci est une évolution clinique attendue du SMD et la relation avec le romiplostim n’est pas claire.
- Perte de réponse thérapeutique au traitement par romiplostim :
- En cas de diminution de la réponse ou de l’échec de maintien d’une réponse plaquettaire avec romiplostim dans l’intervalle des posologies recommandées, il est nécessaire d’en rechercher l’origine, notamment l’immunogénicité (cf Effets indésirables) et l’augmentation de réticuline dans la moelle osseuse (cf ci-dessus).
- Effets du romiplostim sur les globules rouges et les globules blancs :
- Des modifications des taux de globules rouges (diminution) et de globules blancs (augmentation) ont été observées dans les études précliniques de toxicologie (chez le rat et le singe), mais pas chez les patients présentant un PTI. La surveillance de ces taux doit être envisagée chez les patients traités par romiplostim.
INTERACTIONS |
Aucune étude d’interaction n’a été réalisée. Les interactions potentielles entre le romiplostim et d’autres médicaments coadministrés résultant de la liaison aux protéines plasmatiques restent inconnues.
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Aucune donnée clinique n’est disponible sur l’utilisation du romiplostim au cours de la grossesse.
Des études effectuées chez l’animal ont mis en évidence une toxicité sur la reproduction, telle que le passage transplacentaire et l’augmentation du taux de plaquettes foetal chez le rat (cf Sécurité préclinique). Le risque potentiel chez l’homme n’est pas connu.
Le romiplostim ne doit pas être utilisé au cours de la grossesse à moins d’une nécessité absolue.
Allaitement :
Le passage du romiplostim dans le lait maternel n’est pas connu. Cependant le risque de passage dans le lait maternel est possible et le risque d’un effet chez l’enfant allaité n’est pas exclu.
La poursuite ou l’arrêt de l’allaitement ou du traitement par romiplostim doivent être décidés en fonction du bénéfice attendu de l’allaitement pour l’enfant et de celui du traitement par romiplostim chez la mère.
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
- Résumé du profil de tolérance :
- Après analyse des données de tous les patients adultes traités pour PTI et ayant reçu du romiplostim dans 4 essais contrôlés et 5 essais non contrôlés, l’incidence globale des effets indésirables chez les patients traités par romiplostim était de 91,5 % (248/271). La durée moyenne de traitement de cette population de patients était de 50 semaines.
- Liste des effets indésirables :
- Les fréquences sont définies comme suit : très fréquent (>= 1/10), fréquent (>= 1/100 et < 1/10) et peu fréquent (>= 1/1000 et < 1/100). Dans chaque classe de systèmes d’organes MedDRA et chaque groupe de fréquence, les effets indésirables sont présentés par ordre d’incidence décroissant.
- Affections hématologiques et du système lymphatique :
- Fréquent : anomalies de la moelle osseuse*, thrombopénie*.
- Peu fréquent : anémie, anémie aplasique, insuffisance médullaire, hyperleucocytose, splénomégalie, thrombocytémie, taux de plaquettes augmenté, taux de plaquettes anormal.
- Fréquent : anomalies de la moelle osseuse*, thrombopénie*.
- Affections cardiaques :
- Peu fréquent : infarctus du myocarde, fréquence cardiaque augmentée.
- Peu fréquent : infarctus du myocarde, fréquence cardiaque augmentée.
- Affections de l’oreille et du labyrinthe :
- Peu fréquent : vertige.
- Peu fréquent : vertige.
- Affections oculaires :
- Peu fréquent : hémorragie conjonctivale, trouble de l’accommodation, cécité, trouble oculaire, prurit oculaire, larmoiement, oedème papillaire, troubles visuels.
- Peu fréquent : hémorragie conjonctivale, trouble de l’accommodation, cécité, trouble oculaire, prurit oculaire, larmoiement, oedème papillaire, troubles visuels.
- Affections gastro-intestinales :
- Fréquent : nausées, diarrhée, douleur abdominale, constipation, dyspepsie.
- Peu fréquent : vomissement, hémorragie rectale, haleine odorante, dysphagie, reflux gastro-oesophagien, sang dans les selles, hémorragie buccale, inconfort gastrique, stomatite, décoloration des dents.
- Fréquent : nausées, diarrhée, douleur abdominale, constipation, dyspepsie.
- Troubles généraux et anomalies au site d’administration :
- Fréquent : fatigue, oedème périphérique, syndrome pseudogrippal, douleur, asthénie, pyrexie, frissons, réaction au site d’injection.
- Peu fréquent : hémorragie au site d’injection, douleur thoracique, irritabilité, malaise, oedème du visage, sensation de chaleur, sensation de nervosité.
- Fréquent : fatigue, oedème périphérique, syndrome pseudogrippal, douleur, asthénie, pyrexie, frissons, réaction au site d’injection.
- Affections hépatobiliaires :
- Peu fréquent : thrombose de la veine porte, augmentation des transaminases.
- Peu fréquent : thrombose de la veine porte, augmentation des transaminases.
- Infections et infestations :
- Peu fréquent : grippe, infection localisée, rhinopharyngite.
- Peu fréquent : grippe, infection localisée, rhinopharyngite.
- Lésions, intoxications et complications liées aux procédures :
- Fréquent : contusion.
- Fréquent : contusion.
- Investigations :
- Peu fréquent : pression artérielle augmentée, augmentation du taux sanguin de lactate déshydrogénase, augmentation de la température corporelle, perte de poids, prise de poids.
- Peu fréquent : pression artérielle augmentée, augmentation du taux sanguin de lactate déshydrogénase, augmentation de la température corporelle, perte de poids, prise de poids.
- Troubles du métabolisme et de la nutrition :
- Peu fréquent : intolérance à l’alcool, anorexie, diminution de l’appétit, déshydratation, goutte.
- Peu fréquent : intolérance à l’alcool, anorexie, diminution de l’appétit, déshydratation, goutte.
- Affections musculosquelettiques et systémiques :
- Fréquent : arthralgies, myalgies, spasmes musculaires, douleurs des extrémités, douleurs du dos, douleurs osseuses.
- Peu fréquent : crampe musculaire, faiblesse musculaire, douleur à l’épaule, tremblement musculaire.
- Fréquent : arthralgies, myalgies, spasmes musculaires, douleurs des extrémités, douleurs du dos, douleurs osseuses.
- Tumeurs bénignes, malignes et non précisées (incluant kystes et polypes) :
- Peu fréquent : myélome multiple, myélofibrose.
- Peu fréquent : myélome multiple, myélofibrose.
- Affections du système nerveux :
- Très fréquent : céphalées.
- Fréquent : vertiges, paresthésies, migraine.
- Peu fréquent : clonies, dysgueusie, hypoesthésie, hypogueusie, neuropathie périphérique, thrombose du sinus transverse.
- Très fréquent : céphalées.
- Affections psychiatriques :
- Fréquent : insomnie.
- Peu fréquent : dépression, rêves anormaux.
- Fréquent : insomnie.
- Affections du rein et des voies urinaires :
- Peu fréquent : protéinurie.
- Peu fréquent : protéinurie.
- Affections des organes de reproduction et du sein :
- Peu fréquent : hémorragie vaginale.
- Peu fréquent : hémorragie vaginale.
- Affections respiratoires, thoraciques et médiastinales :
- Fréquent : embolie pulmonaire*.
- Peu fréquent : toux, rhinorrhée, gorge sèche, dyspnée, congestion nasale, respiration douloureuse.
- Fréquent : embolie pulmonaire*.
- Affections de la peau et du tissu sous-cutané :
- Fréquent : prurit, ecchymoses, rash.
- Peu fréquent : alopécie, réaction de photosensibilité, acné, dermatite de contact, peau sèche, eczéma, érythème, rash exfoliatif, pousse des cheveux anormale, prurigo, purpura, rash papulaire, rash pruritique, nodule cutané, odeur cutanée anormale, urticaire.
- Fréquent : prurit, ecchymoses, rash.
- Affections vasculaires :
- Fréquent : bouffées vasomotrices.
- Peu fréquent : thrombose veineuse profonde, hypotension, embolie périphérique, ischémie périphérique, phlébite, thrombophlébite superficielle, thrombose.
- Fréquent : bouffées vasomotrices.
-
*
Cf Mises en garde et Précautions d’emploi.
- Description d’effets indésirables sélectionnés :
- Les effets listés ci-dessous ont été considérés comme reliés au traitement par romiplostim.
-
- Thrombocytose :
- Après analyse des données de tous les patients adultes traités pour PTI par romiplostim dans 4 essais contrôlés et 5 essais non contrôlés, 3 cas de thrombocytose ont été rapportés, n = 271. Aucune conséquence clinique associée à cette élévation du taux de plaquettes n’a été rapportée chez aucun des 3 patients.
-
- Thrombopénie après arrêt du traitement :
- Après analyse des données de tous les patients adultes traités pour PTI par romiplostim dans 4 essais contrôlés et 5 essais non contrôlés, 4 cas de thrombopénie après arrêt du traitement ont été rapportés, n = 271 (cf Mises en garde et Précautions d’emploi).
-
- Augmentation de la réticuline dans la moelle osseuse :
- Dans les études cliniques, le romiplostim a été interrompu chez 4 patients sur 271 en raison de dépôts de réticuline dans la moelle osseuse. La réticuline a été observée sur biopsie de moelle osseuse chez 6 autres patients (cf Mises en garde et Précautions d’emploi).
-
- Immunogénicité :
- La production d’anticorps antiromiplostim a été étudiée au cours des essais cliniques menés chez les patients adultes atteints de PTI.
- Bien que 5,8 % et 3,9 % des patients ont présenté des tests positifs au développement d’anticorps se liant respectivement au romiplostim et à la TPO, seuls 2 patients (0,4 %) étaient positifs aux anticorps neutralisant l’activité du romiplostim ; ces anticorps n’ont pas provoqué de réaction croisée avec la TPO endogène. Les deux patients se sont révélés négatifs aux anticorps neutralisant l’activité du romiplostim 4 mois après la fin du traitement. L’incidence des anticorps préexistants dirigés contre le romiplostim et la TPO était respectivement de 8 % et de 5,4 %.
- Comme avec toutes les protéines thérapeutiques, il existe un risque potentiel d’immunogénicité. S’il y a soupçon de formation d’anticorps neutralisants, contacter Amgen pour que les tests immunologiques puissent être réalisés (cf dans la Notice : Informations supplémentaires).
-
- Effets indésirables issus des déclarations spontanées :
- La fréquence des effets indésirables issus des déclarations spontanées, non rapportés au cours des essais cliniques, ne peut pas être estimée (fréquence : non connue). Les effets indésirables spontanément rapportés incluent :
- Affections vasculaires : érythromélalgie.
SURDOSAGE |
PHARMACODYNAMIE |
Classe pharmacothérapeutique : antihémorragiques (code ATC : B02BX04).
Le romiplostim est une protéine fusionnée avec un Fc-peptide (peptibody) qui active la cascade de transcription intracellulaire via le récepteur à la thrombopoïétine (TPO) [connu aussi sous le nom cMplt] pour augmenter la production de plaquettes. Le peptibody comprend le domaine Fc de l’immunoglobuline humaine IgG1. Chaque sous-unité (une chaîne) est liée au niveau C-terminal de façon covalente à une chaîne peptidique contenant deux domaines de liaison au récepteur à la TPO.
Le romiplostim n’a pas d’homologie de séquence d’acides aminés avec la TPO endogène. Dans les études précliniques et cliniques, aucun anticorps antiromiplostim n’a interagi avec la TPO endogène.
- Données cliniques :
- L’efficacité et la tolérance du romiplostim ont été évaluées pendant plus de 3 ans en traitement continu. Dans les études cliniques, l’administration de romiplostim a permis d’obtenir une augmentation dose-dépendante du taux de plaquettes. Le délai pour atteindre l’effet maximal sur le taux de plaquettes est approximativement de 10 à 14 jours indépendamment de la dose. Après une administration unique sous-cutanée de 1 à 10 µg/kg de romiplostim chez des patients présentant un PTI, le pic du taux de plaquettes était 1,3 à 14,9 fois le taux avant instauration du traitement pendant une période de 2 à 3 semaines, et la réponse était variable d’un patient à l’autre. Le taux de plaquettes des patients présentant un PTI et ayant reçu 6 injections hebdomadaires de 1 à 3 µg/kg de romiplostim était compris entre 50 et 450 x 109/l pour la majorité des patients. Parmi les 271 patients traités par romiplostim pour PTI au cours des études cliniques, 55 (20 %) avait 65 ans ou plus, et 27 (10 %) avait 75 ans ou plus. Aucune différence de tolérance ou d’efficacité n’a été observée entre les patients plus âgés ou plus jeunes dans les études contrôlées versus placebo.
-
- Résultats des études pivotales contrôlées versus placebo :
- La tolérance et l’efficacité de romiplostim ont été évaluées dans deux études cliniques en double aveugle contrôlées versus placebo, chez des patients adultes présentant un PTI, représentatifs de l’intégralité de cette population et ayant reçu au moins un traitement avant l’entrée dans l’étude.
- L’étude S1 (212) a évalué des patients non splénectomisés ayant une réponse non satisfaisante ou ayant présenté une intolérance aux précédents traitements. A l’inclusion, le diagnostic de PTI datait d’environ 2 ans et les patients avaient reçu en médiane 3 traitements différents pour leur PTI (intervalle de 1 à 7). Les traitements antérieurs étaient les corticoïdes (90 % des patients), les immunoglobulines (76 %), le rituximab (29 %), les agents cytotoxiques (21 %), le danazol (11 %) et l’azathioprine (5 %). Les patients avaient un taux de plaquettes médian de 19 x 109/l à l’entrée dans l’étude.
- L’étude S2 (105) a évalué des patients splénectomisés et présentant encore une thrombopénie. A l’inclusion, le diagnostic de PTI datait d’environ 8 ans ; en plus de la splénectomie, les patients avaient reçu en médiane 6 traitements différents pour leur PTI (intervalle de 3 à 10). Les traitements antérieurs étaient les corticoïdes (98 % des patients), les immunoglobulines (97 %), le rituximab (71 %), les agents cytotoxiques (68 %), le danazol (37 %) et l’azathioprine (24 %). Les patients avaient un taux de plaquettes médian de 14 x 109/l à l’entrée dans l’étude.
- Les 2 études présentaient la même méthodologie. Les patients (>= 18 ans) étaient randomisés selon un rapport 2:1 de façon à recevoir une dose initiale de romiplostim de 1 µg/kg ou un placebo. Les patients recevaient une injection hebdomadaire sous-cutanée pendant 24 semaines. Les posologies étaient ajustées pour maintenir le taux de plaquettes (50 à 200 x 109/l). Dans les deux études l’efficacité était évaluée par l’augmentation de la proportion de patients atteignant une réponse plaquettaire durable. La posologie hebdomadaire moyenne chez les patients splénectomisés était de 3 µg/kg et de 2 µg/kg chez les patients non splénectomisés.
- Dans les 2 études, une réponse plaquettaire durable a été atteinte chez une proportion significativement plus importante de patients recevant le romiplostim, comparé aux patients recevant le placebo. Dans les études contrôlées versus placebo, après les 4 premières semaines de traitement, le romiplostim a permis le maintien des taux de plaquettes >= 50 x 109/l chez 50 à 70 % des patients pendant une période de traitement de 6 mois. Dans le groupe placebo, de 0 à 7 % des patients ont eu une réponse plaquettaire pendant les 6 mois de traitement. Un résumé des critères d’efficacité est présenté ci-après.
-
- Résumé des principaux résultats des études contrôlées versus placebo :
-
Étude 1
Patients non splénectomisésÉtude 2
Patients splénectomisésÉtudes 1 et 2 combinées R
(n = 41)P
(n = 21)R
(n = 42)P
(n = 21)R
(n = 83)P
(n = 42)Nombre (%) de patients présentant une réponse plaquettaire durable(a) 25
(61 %)1
(5 %)16
(38 %)0
(0 %)41
(50 %)1
(2 %)(IC 95 %) (45 %, 76 %) (0 %, 24 %) (24 %, 54 %) (0 %, 16 %) (38 %, 61 %) (0 %, 13 %) p < 0,0001 0,0013 < 0,0001 Nombre (%) de patients présentant une réponse plaquettaire globale(b) 36
(88 %)3
(14 %)33
(79 %)0
(0 %)69
(83 %)3
(7 %)(IC 95 %) (74 %, 96 %) (3 %, 36 %) (63 %, 90 %) (0 %, 16 %) (73 %, 91 %) (2 %, 20 %) p < 0,0001 < 0,0001 < 0,0001 Nombre moyen de semaines avec réponse plaquettaire(c) 15 1 12 0 14 1 (SD) 3,5 7,5 7,9 0,5 7,8 2,5 p < 0,0001 < 0,0001 < 0,0001 Nombre (%) de patients ayant eu recours à un traitement d’urgence(d) 8
(20 %)13
(62 %)11
(26 %)12
(57 %)19
(23 %)25
(60 %)(IC 95 %) (9 %, 35 %) (38 %, 82 %) (14 %, 42 %) (34 %, 78 %) (14 %, 33 %) (43 %, 74 %) p 0,001 0,0175 < 0,0001 Nombre (%) de patients présentant une réponse plaquettaire durable à dose stable(e) 21
(51 %)0
(0 %)13
(31 %)0
(0 %)34
(41 %)0
(0 %)(IC 95 %) (35 %, 67 %) (0 %, 16 %) (18 %, 47 %) (0 %, 16 %) (30 %, 52 %) (0 %, 8 %) p 0,0001 0,0046 < 0,0001 - R = romiplostim ; P = placebo.
-
(a)
La réponse plaquettaire durable était définie par un taux de plaquettes hebdomadaire >= 50 x 109/l pendant au moins 6 semaines lors des semaines 18 à 25, en l’absence de traitement d’urgence à un quelconque moment de la période de traitement.
-
(b)
La réponse plaquettaire globale était définie par une réponse plaquettaire durable ou transitoire. La réponse plaquettaire transitoire était définie par un taux de plaquettes hebdomadaire >= 50 x 109/l pendant au moins 4 semaines lors des semaines 2 à 25 mais sans réponse plaquettaire durable. Les patients pouvaient ne pas avoir de réponse hebdomadaire pendant 8 semaines après avoir reçu un traitement d’urgence.
-
(c)
Le nombre de semaines avec une réponse plaquettaire était défini par le nombre de semaines avec un taux de plaquettes >= 50 x 109/l pendant les semaines 2 à 25 de l’essai. Les patients pouvaient ne pas avoir de réponse dans les 8 semaines suivant l’administration de traitement d’urgence.
-
(d)
Les traitements d’urgence étaient définis comme tout traitement administré en vue d’augmenter le taux de plaquettes. Les patients ayant eu besoin de traitement de secours n’étaient pas pris en compte en ce qui concerne la réponse plaquettaire durable. Les traitements de secours autorisés dans les essais étaient les IgIV, les transfusions de plaquettes, les immunoglobulines anti-D et les corticoïdes.
-
(e)
Une dose stable était définie par la dose ± 1 µg/kg maintenue pendant les 8 dernières semaines de traitement.
-
- Réduction des traitements concomitants du PTI :
- Dans les 2 études contrôlées versus placebo en double aveugle, les patients recevant déjà des traitements du PTI selon un schéma posologique constant étaient autorisés à poursuivre ces traitements pendant l’étude (corticoïdes, danazol et/ou azathioprine). Au début de l’étude, 21 patients non splénectomisés et 18 splénectomisés recevaient certains de ces traitements concomitants (principalement des corticostéroïdes). A la fin de la période de traitement, tous les patients splénectomisés ayant reçu du romiplostim (100 %) ont pu arrêter ou réduire la dose de plus de 25 % de leurs traitements concomitants du PTI, comparativement à 17 % des patients ayant reçu le placebo. 73 % des patients non splénectomisés ayant reçu du romiplostim ont pu arrêter ou réduire la dose de plus de 25 % de leurs traitements concomitants du PTI, par rapport à 50 % des patients ayant reçu le placebo (cf Interactions).
-
- Événements hémorragiques :
- Au cours du développement clinique dans le PTI, il a été observé une relation inverse entre les événements hémorragiques et le taux de plaquettes. Tous les événements hémorragiques cliniquement significatifs (>= grade 3) sont survenus pour un taux de plaquettes < 30 x 109/l. Tous les événements hémorragiques >= grade 2 sont survenus quand les taux de plaquettes étaient < 50 x 109/l. Aucune différence statistiquement significative sur l’incidence globale des événements hémorragiques n’a été observée entre les patients recevant Nplate et les patients recevant le placebo.
- Dans les deux études contrôlées versus placebo, 9 patients ont présenté des saignements considérés comme graves (5 [6,0 %] romiplostim, 4 [9,8 %] placebo ; Odds Ratio [romiplostim/placebo] = 0,59 ; IC 95 % = [0,15-2,31]). Des événements hémorragiques de grade 2 ou plus ont été rapportés chez 15 % des patients traités par romiplostim et 34 % des patients recevant le placebo (Odds Ratio [romiplostim/placebo] = 0,35 ; IC 95 % = [0,14-0,85]).
PHARMACOCINÉTIQUE |
La pharmacocinétique de romiplostim implique vraisemblablement une voie de signalisation médiée par les récepteurs à la thrombopoïétine (TPO) présents au niveau des plaquettes et d’autres cellules de la lignée plaquettaire telles que les mégacaryocytes.
- Absorption :
- Après administration sous-cutanée de 3 à 15 µg/kg de romiplostim, les taux sériques maximaux de romiplostim sont obtenus après 7 à 50 heures (médiane 14 heures) chez les patients traités pour PTI. Les concentrations sériques varient d’un patient à l’autre et ne sont pas corrélées à la dose administrée. Les taux sériques de romiplostim apparaissent inversement corrélés aux taux de plaquettes.
- Distribution :
- Le volume de distribution du romiplostim après administration intraveineuse de 0,3 µg/kg, 1,0 µg/kg et 10 µg/kg décroît de façon non linéaire, respectivement de 122 ml/kg, 78,8 ml/kg à 48,2 ml/kg chez le volontaire sain. Cette diminution non linéaire du volume de distribution est cohérente avec la fixation du romiplostim sur les récepteurs cibles (au niveau des mégacaryocytes et des plaquettes), qui peuvent être saturés après administration des plus fortes doses.
- Élimination :
- La demi-vie d’élimination du romiplostim chez les patients traités pour un PTI est comprise entre 1 et 34 jours (médiane 3,5 jours). L’élimination sérique du romiplostim est en partie dépendante des récepteurs plaquettaires à la TPO. Il en résulte que, pour une dose donnée, les patients ayant des taux plaquettaires élevés ont des concentrations sériques basses et inversement. Au cours d’une autre étude clinique dans le PTI, aucune accumulation sérique n’a été observée après 6 semaines de traitement par romiplostim à la posologie de 3 µg/kg.
- Populations particulières :
- La pharmacocinétique du romiplostim n’a pas été étudiée chez les patients insuffisants rénaux ni chez les patients insuffisants hépatiques. Les paramètres pharmacocinétiques du romiplostim ne semblent pas être influencés par l’âge, le poids ou le sexe, de manière cliniquement significative.
SÉCURITE PRÉCLINIQUE |
La toxicité à doses répétées du romiplostim a été étudiée sur 4 semaines chez le rat et jusqu’à 6 mois chez le singe. Les effets observés au cours de ces études étaient liés à l’activité thrombopoïétique du romiplostim et étaient comparables, quelle que soit la durée de l’étude. Des réactions au site d’injection ont été observées, liées à l’administration du romiplostim. Des myélofibroses ont été observées dans la moelle osseuse de rats à toutes les doses testées. Au cours de ces études, les myélofibroses ont régressé chez les animaux en 4 semaines, indiquant une réversibilité de cet effet.
Dans une étude toxicologique d’un mois chez le rat et le singe, une diminution modérée du taux de globules rouges, de l’hématocrite et de l’hémoglobine a été observée. Une stimulation de la production de leucocytes a également été constatée car les taux de neutrophiles, lymphocytes, monocytes et éosinophiles ont modérément augmenté. Dans l’étude la plus longue menée chez le singe, à doses répétées, il n’y a pas eu d’effet sur les lignées érythrocytaire et leucocytaire lors de l’administration du romiplostim pendant 6 mois au cours desquels le schéma d’administration est passé de trois fois par semaine à une fois pas semaine. De plus, dans les études pivotales de phase III, le romiplostim n’a pas eu d’effet sur les lignées érythrocytaire et leucocytaire par rapport aux patients ayant reçu le placebo.
Du fait de la formation d’anticorps neutralisants chez le rat, une diminution des effets pharmacodynamiques du romiplostim était souvent observée après administration prolongée. Les études de toxicocinétique n’ont pas montré de relation entre les anticorps et les concentrations mesurées. Bien que de fortes doses aient été testées chez l’animal, les marges de sécurité ne peuvent être estimées de façon fiable chez l’homme du fait de différences de sensibilité vis-à-vis de la pharmacodynamie du romiplostim et des effets des anticorps neutralisants.
- Carcinogénicité :
- Aucune étude spécifique n’a été menée pour étudier le potentiel carcinogène. Le risque carcinogène du romiplostim chez l’homme n’est pas connu.
- Toxicité de la reproduction :
- Au cours de toutes les études, la formation d’anticorps neutralisants a été observée ; ceux-ci ont pu inhiber les effets du romiplostim. Les études de développement embryofoetal chez la souris et le rat montrent une réduction du poids maternel chez la souris uniquement. Chez la souris, une augmentation des avortements précoces a été mise en évidence. Une augmentation de la durée de la gestation et une légère augmentation de l’incidence de la mortalité périnatale ont été observées au cours d’une étude de développement pré et postnatal chez le rat. Le romiplostim passe la barrière placentaire chez le rat, et pourrait être transmis de la mère au foetus et stimuler la production de plaquettes chez le foetus. Le romiplostim n’a montré aucun effet sur la fertilité chez le rat.
INCOMPATIBILITÉS |
En l’absence d’étude de compatibilité, ce médicament ne doit pas être mélangé avec d’autres médicaments, à l’exception de ceux mentionnés dans la rubrique Modalités de manipulation/élimination.
MODALITÉS DE CONSERVATION |
- Durée de conservation :
- 2 ans.
A conserver au réfrigérateur (entre 2 °C et 8 °C). Ne pas congeler. A conserver dans l’emballage d’origine à l’abri de la lumière.
- Après reconstitution :
- La stabilité physicochimique a été démontrée pendant 24 heures à 25 °C et pendant 24 heures à 2 °C – 8 °C, à l’abri de la lumière et conservé dans le flacon d’origine.
- D’un point de vue microbiologique, le produit doit être utilisé immédiatement après reconstitution. S’il n’est pas utilisé immédiatement, les durées et conditions de conservation sont de la responsabilité de l’utilisateur et ne doivent normalement pas excéder 24 heures à 25 °C ou 24 heures au réfrigérateur (entre 2 °C et 8 °C), à l’abri de la lumière.
MODALITÉS MANIPULATION/ÉLIMINATION |
Nplate est un produit stérile sans conservateur destiné seulement à un usage unique. Nplate doit être reconstitué dans des conditions d’asepsie rigoureuses.
Pour les conditions de conservation du médicament reconstitué, cf Modalités de conservation.
- Nplate 250 µg poudre pour solution injectable doit être reconstitué avec 0,72 ml d’eau pour préparations injectables, donnant un volume injectable de 0,5 ml. Chaque flacon contient un surremplissage permettant d’assurer l’administration de la dose de 250 µg de romiplostim,
ou
- Nplate 500 µg poudre pour solution injectable doit être reconstitué avec 1,2 ml d’eau pour préparations injectables, donnant un volume injectable de 1 ml. Chaque flacon contient un surremplissage permettant d’assurer l’administration de la dose de 500 µg de romiplostim.
D’un point de vue microbiologique, le produit doit être utilisé immédiatement après reconstitution. S’il n’est pas utilisé immédiatement, les durées et conditions de conservation sont de la responsabilité de l’utilisateur et ne doivent normalement pas excéder 24 heures à 25 °C ou 24 heures au réfrigérateur (entre 2 °C et 8 °C), à l’abri de la lumière.
- Retirer le capuchon en plastique du flacon de poudre de Nplate et nettoyer le bouchon en caoutchouc à l’aide des compresses alcoolisées fournies.
- Fixer l’adaptateur de flacon au flacon de Nplate en retirant la pellicule protectrice de l’adaptateur de flacon, en veillant à le maintenir dans son emballage. Tout en maintenant le flacon posé à plat, enfoncer fermement l’adaptateur au centre du flacon jusqu’à ce qu’il soit bien en place.
Remarque : Afin d’éviter toute contamination du médicament, ne pas toucher la pointe de l’adaptateur ou Luer-lock.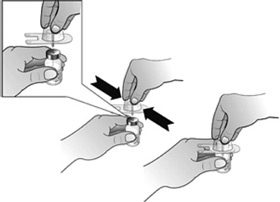
- Retirer et jeter l’emballage de l’adaptateur de flacon.
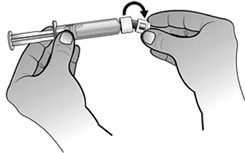
- Fixer le piston à la seringue préremplie d’eau pour préparations injectables en tournant le piston dans le sens des aiguilles d’une montre jusqu’à sentir une légère résistance.
- En tenant la seringue préremplie d’eau pour préparations injectables dans une main, replier l’extrémité de la protection en plastique blanc avec l’autre main. Ceci brisera le scellé de la protection en plastique blanc. Une fois ce scellé brisé, retirer la protection pour séparer le capuchon en plastique gris de l’extrémité en plastique clair de la seringue.
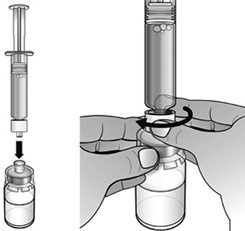
- En maintenant le flacon posé à plat, fixer la seringue préremplie d’eau pour préparations injectables à l’adaptateur de flacon : Tenir le bord extérieur de l’adaptateur de flacon d’une main et tourner l’embout de la seringue dans le sens des aiguilles d’une montre dans l’adaptateur avec l’autre main, jusqu’à sentir une légère résistance.
- Expulser lentement et délicatement l’eau dans le flacon de poudre. L’eau doit couler lentement sur la poudre. Remuer délicatement le flacon jusqu’à dissolution complète de la poudre et jusqu’à ce que la solution soit claire et incolore.
Ne pas secouer ou agiter le flacon. - Note : D’un point de vue microbiologique, le médicament doit être utilisé immédiatement après reconstitution. S’il n’est pas utilisé immédiatement, la seringue ne doit pas être retirée de l’adaptateur de flacon afin de maintenir une intégrité microbiologique.
Remarque : La dissolution complète de la poudre peut prendre jusqu’à 2 minutes.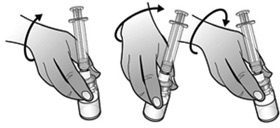
- Avant de poursuivre : Inspecter visuellement la solution reconstituée pour rechercher des particules et/ou une coloration. La solution reconstituée doit être claire et incolore. Elle ne doit pas être administrée si l’on observe des particules et/ou une coloration.
- S’assurer que la poudre est totalement dissoute avant de retirer la seringue.
- Retirer la seringue préremplie vide de l’adaptateur de flacon.
- Retirer la seringue de 1 ml de son emballage. Fixer cette seringue de 1 ml à l’adaptateur de flacon de la solution reconstituée en tournant l’embout de la seringue dans l’adaptateur de flacon jusqu’à sentir une légère résistance.
- Retourner l’ensemble seringue-flacon afin que le flacon de la solution reconstituée se retrouve au-dessus de la seringue. Prélever tout le volume de la solution reconstituée dans la seringue destinée à l’administration.
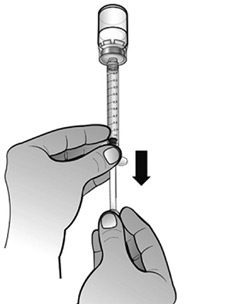
- S’assurer que le volume de solution dans la seringue d’administration corresponde à la dose prescrite pour le patient, en expulsant l’excès de solution dans le flacon.
- Remarque : Éliminer toutes les bulles d’air de la seringue afin d’avoir le volume exact de solution dans la seringue.
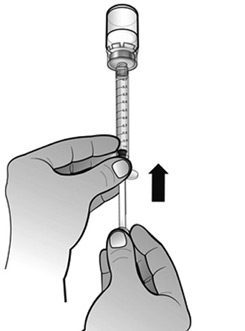
- Retirer la seringue destinée à l’administration de l’adaptateur de flacon.
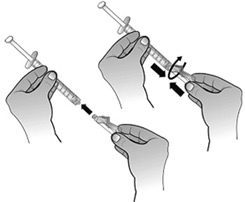
- Fixer l’aiguille sécurisée à la seringue destinée à l’administration préalablement remplie en tournant l’aiguille dans le sens des aiguilles d’une montre dans l’embout Luer-lock.
- Préparer le site d’injection à l’aide d’une compresse alcoolisée. Relever le système de sécurité rose vers la seringue en dégageant l’aiguille.
- Retirer le capuchon de l’aiguille en tenant la seringue d’une main et en tirant soigneusement sur le capuchon, sans le tourner, de l’autre main.
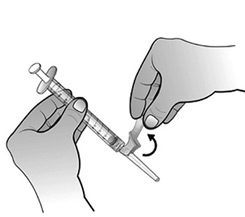
- Injecter par voie sous-cutanée conformément aux bonnes pratiques en vigueur.
- Après injection, activer le système de sécurité rose en poussant le cran de sécurité avec la même main jusqu’à entendre un clic et/ou jusqu’à ressentir la fermeture.
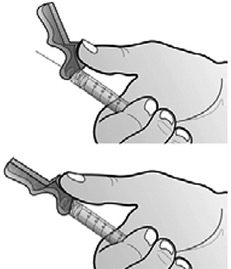
- Éliminer immédiatement la seringue et l’aiguille dans des containers pour matériel médical usagé prévus à cet effet.
Tout produit inutilisé ou matériel usagé doit être éliminé conformément à la réglementation en vigueur.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| Médicament soumis à prescription hospitalière. | |
| Prescription réservée aux spécialistes en hématologie ou en médecine interne. | |
| Médicament nécessitant une surveillance particulière pendant le traitement. | |
| EU/1/08/497/005 ; CIP 3400935985583 (RCP rév 26.11.2010) 250 µg pdre et solv. | |
| EU/1/08/497/007 ; CIP 3400935996411 (RCP rév 26.11.2010) 500 µg pdre et solv. | |
| Prix : | 677.73 euros (1 flacon de poudre et solvant à 250 µg). |
| 1329.82 euros (1 flacon de poudre et solvant à 500 µg). | |
| Remb Séc soc à 65 %. Collect. | |
Titulaire de l’AMM : Amgen Europe B.V., Minervum 7061, 4817 ZK Breda, Pays-Bas.
AMGEN
62, bd Victor-Hugo. 92200 Neuilly-sur-Seine
Tél : 01 40 88 27 00. Fax : 01 40 88 27 90
Info médic et pharmacovigilance :
Tél : 09 69 36 33 63
Liste Des Sections Les Plus Importantes :
- pathologies
- Medicaments
- Medicaments injectables
- Traitement D’Urgence
- Guide Infirmier Des Examens De Laboratoire
- Infirmiers En Urgences
- Fiche Technique Medical
- Techniques De Manipulations En Radiologie Medicale
- Bibliotheque_medicale



