fentanyl
FORMES et PRÉSENTATIONS |
COMPOSITION |
| p cp | |
| Fentanyl (DCI) citrate exprimé en fentanyl | 100 µg |
| ou | 200 µg |
| ou | 400 µg |
| ou | 600 µg |
| ou | 800 µg |
Teneur en sodium : 8 mg/cp à 100 µg ; 16 mg/cp à 200 µg, 400 µg, 600 µg et 800 µg.
INDICATIONS |
POSOLOGIE ET MODE D’ADMINISTRATION |
- Titration de la dose :
- La posologie efficace d’Effentora doit être déterminée individuellement pour chaque patient (titration), c’est-à-dire la dose produisant l’effet antalgique approprié avec un minimum d’effets indésirables. Lors des études cliniques, il n’a pas été possible de prédire la dose efficace d’Effentora pour le traitement des accès douloureux paroxystiques en fonction de la dose quotidienne du traitement de fond morphinique.
- Les patients doivent être surveillés étroitement jusqu’à l’obtention d’une dose efficace.
-
- Titration chez des patients recevant du fentanyl pour la première fois :
- La dose initiale d’Effentora doit être de 100 µg, avec augmentation de la posologie, si nécessaire, conformément à la gamme de dosages disponibles (100, 200, 400, 600, et 800 µg).
-
- Titration chez des patients passant d’un autre médicament contenant du fentanyl à Effentora :
- Compte tenu du fait que ces produits possèdent des profils d’absorption différents, la substitution ne doit pas se faire selon un rapport de 1:1. Chez les patients passant d’une autre forme orale de citrate de fentanyl à Effentora, la titration de la dose d’Effentora doit être réalisée indépendamment étant donné que la biodisponibilité entre les produits diffère significativement. Néanmoins, chez ces patients, une dose initiale supérieure à 100 µg peut être envisagée.
-
- Méthode de titration :
- Durant la titration, si une analgésie satisfaisante n’est pas obtenue dans les 30 minutes suivant l’administration de 1 seul comprimé, un 2e comprimé d’Effentora du même dosage peut être utilisé.
- Si le traitement d’un accès douloureux paroxystique requiert plus d’un comprimé, il convient d’envisager de passer au dosage immédiatement supérieur pour le traitement de l’accès douloureux paroxystique suivant.
- Plusieurs comprimés peuvent être utilisés lors de la phase titration de la dose : jusqu’à 4 comprimés de 100 µg ou jusqu’à 4 comprimés de 200 µg peuvent être utilisés pour traiter un seul accès douloureux paroxystique selon le schéma suivant :
- Si la prise initiale d’un comprimé à 100 µg n’est pas efficace, il faut informer le patient qu’il doit traiter le prochain accès douloureux paroxystique avec 2 comprimés de 100 µg. Il est recommandé de placer 1 comprimé de chaque côté de la bouche. Si cette dose est considérée comme la dose efficace, le traitement des accès douloureux paroxystiques ultérieurs doit être poursuivi avec 1 seul comprimé de 200 µg d’Effentora.
- Si l’utilisation de 1 seul comprimé de 200 µg d’Effentora (ou de 2 comprimés de 100 µg) n’est pas considérée comme étant efficace, il faut indiquer au patient de prendre 2 comprimés de 200 µg (ou 4 comprimés de 100 µg) pour traiter l’accès douloureux paroxystique suivant. Il est recommandé de placer 2 comprimés de chaque côté de la bouche. Si cette dose est considérée comme la dose efficace, le traitement des accès douloureux paroxystiques ultérieurs doit être poursuivi avec 1 seul comprimé de 400 µg d’Effentora.
- Il convient d’utiliser des comprimés de 200 µg pour une augmentation posologique à 600 µg ou à 800 µg.
- Si la prise initiale d’un comprimé à 100 µg n’est pas efficace, il faut informer le patient qu’il doit traiter le prochain accès douloureux paroxystique avec 2 comprimés de 100 µg. Il est recommandé de placer 1 comprimé de chaque côté de la bouche. Si cette dose est considérée comme la dose efficace, le traitement des accès douloureux paroxystiques ultérieurs doit être poursuivi avec 1 seul comprimé de 200 µg d’Effentora.
- Des doses supérieures à 800 µg n’ont pas été évaluées lors des études cliniques.
- Il ne faudra pas utiliser plus de 2 comprimés pour traiter un même accès douloureux paroxystique, sauf lors de l’adaptation posologique décrite ci-dessus, utilisant jusqu’à 4 comprimés. Lors de la titration, les patients doivent attendre au moins 4 heures avant de traiter un autre accès douloureux paroxystique par Effentora.
- Traitement d’entretien :
- Une fois la dose efficace déterminée lors de la phase de titration, les patients doivent continuer d’utiliser 1 seul comprimé de cette dose. Les accès douloureux paroxystiques peuvent varier en intensité et la dose requise d’Effentora pourrait augmenter avec le temps en raison de la progression de la maladie cancéreuse sous-jacente. Dans ces cas, un 2e comprimé de la même dose peut être utilisé. Si un 2e comprimé d’Effentora s’est avéré nécessaire plusieurs fois de suite, la dose d’entretien habituelle devrait être réajustée (voir ci-dessous).
- Lors du traitement d’entretien, les patients doivent attendre au moins 4 heures avant de traiter un autre accès douloureux paroxystique.
- Réajustement de la dose :
- La dose d’entretien d’Effentora doit être augmentée si le traitement de plusieurs accès douloureux paroxystiques consécutifs requiert plus de 1 comprimé par accès. Pour la dose de réajustement les mêmes principes que ceux décrits pour la titration s’appliquent (voir ci-dessus).
- Si les patients présentent régulièrement plus de quatre accès douloureux paroxystiques par 24 heures, il peut être nécessaire de réajuster le traitement morphinique de fond.
- Arrêt du traitement :
- Le traitement par Effentora doit être immédiatement arrêté lorsqu’il ne s’avère plus nécessaire.
- Utilisation chez l’enfant et l’adolescent :
- Effentora ne doit pas être utilisé chez l’enfant et l’adolescent de moins de 18 ans compte tenu du manque de données concernant la sécurité et l’efficacité.
- Utilisation chez le sujet âgé (de plus de 65 ans) :
- Au cours des études cliniques, la dose efficace tendait à être plus faible chez les patients âgés de plus de 65 ans que chez les patients plus jeunes. La plus grande prudence est de rigueur lors de la titration de la dose d’Effentora chez les patients âgés.
- Insuffisance hépatique ou rénale :
- Effentora doit être administré avec prudence chez les patients présentant une insuffisance rénale ou hépatique modérée à sévère (cf Mises en garde et Précautions d’emploi).
- Patients présentant une xérostomie :
- Il est conseillé aux patients présentant une xérostomie de boire de l’eau avant l’administration d’Effentora afin d’humidifier la cavité buccale. Il est conseillé de changer de traitement dans le cas où cette recommandation ne suffirait pas à obtenir une effervescence appropriée du comprimé.
- Mode d’administration :
- En présence d’humidité, le comprimé d’Effentora utilise une réaction effervescente pour délivrer la substance active. Il est donc recommandé aux patients de ne pas ouvrir la plaquette thermoformée avant d’être prêts à placer le comprimé dans la cavité buccale.
-
- Ouverture de la plaquette thermoformée :
- Les patients doivent être informés de ne pas essayer de pousser le comprimé à travers la feuille de couverture car cela pourrait endommager le comprimé gingival.
- La méthode appropriée pour l’ouverture de la plaquette thermoformée est :
- Détacher une des alvéoles de la plaquette thermoformée en découpant selon les perforations.
- Plier l’alvéole le long de la ligne imprimée sur la feuille de couverture.
- Retirer la feuille de couverture pour laisser apparaître le comprimé.
- Détacher une des alvéoles de la plaquette thermoformée en découpant selon les perforations.
- Les patients doivent être prévenus qu’il ne faut pas écraser ni couper le comprimé.
- Le comprimé ne doit pas être conservé une fois la feuille de couverture retirée car l’intégrité du comprimé ne peut être garantie dans ce cas et il existe un risque d’exposition accidentelle au produit.
-
- Administration des comprimés :
- Les patients doivent retirer un comprimé de la plaquette thermoformée et le placer immédiatement dans la cavité buccale (près d’une molaire entre la joue et la gencive).
- Le comprimé d’Effentora ne doit pas être sucé, mâché ou avalé, car les concentrations plasmatiques seraient alors inférieures à celles obtenues lors de l’utilisation selon les instructions.
- Effentora doit être placé dans la cavité buccale et y rester pendant une période de temps suffisante pour permettre la désintégration du comprimé, ce qui prend généralement 14 à 25 minutes. Le comprimé peut également être placé sous la langue (cf Pharmacocinétique).
- Après 30 minutes, s’il reste des morceaux de comprimé d’Effentora, il est possible de les avaler avec un verre d’eau.
- Le temps de désintégration totale du comprimé après administration par voie buccale transmuqueuse ne semble pas avoir d’influence sur l’exposition systémique précoce au fentanyl.
- Lorsqu’un comprimé se trouve dans la cavité buccale, les patients ne doivent ni boire ni manger. En cas d’irritation des muqueuses buccales, il est recommandé de changer l’emplacement du comprimé.
CONTRE-INDICATIONS |
- Hypersensibilité à la substance active ou à l’un des excipients.
- Patients non traités par un traitement de fond morphinique, en raison d’un risque accru de dépression respiratoire.
- Dépression respiratoire sévère ou obstruction sévère des voies aériennes.
- Traitement de la douleur aiguë autre que les accès douloureux paroxystiques (exemple : les douleurs postopératoires, les maux de tête, la migraine).
MISES EN GARDE et PRÉCAUTIONS D’EMPLOI |
INTERACTIONS |
Le fentanyl est principalement métabolisé par l’isoenzyme 3A4 du cytochrome P450 (CYP 3A4). Par conséquent, des interactions potentielles peuvent survenir en cas d’administration concomitante d’Effentora et d’agents ayant un effet sur l’activité du CYP 3A4. L’efficacité d’Effentora peut être réduite en cas d’administration concomitante d’agents ayant un effet inducteur sur l’activité du CYP 3A4. L’administration concomitante d’Effentora et d’inhibiteurs puissants du CYP 3A4 (par exemple, ritonavir, kétoconazole, itraconazole, troléandomycine, clarithromycine et nelfinavir) ou modérés (par exemple, amprénavir, aprépitant, diltiazem, érythromycine, fluconazole, fosamprénavir, jus de pamplemousse et vérapamil) est susceptible d’augmenter les concentrations plasmatiques de fentanyl, ce qui pourrait entraîner des effets indésirables graves, y compris une dépression respiratoire. Les patients recevant Effentora en même temps que des inhibiteurs modérés ou puissants du CYP 3A4 doivent faire l’objet d’une surveillance étroite pendant une période de temps prolongée. L’augmentation posologique doit être réalisée avec prudence.
FERTILITÉ/GROSSESSE/ALLAITEMENT |
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
Investigations :
- Fréquent : perte de poids.
- Peu fréquent : diminution du nombre de plaquettes, augmentation de la fréquence cardiaque, diminution de l’hématocrite, diminution du taux d’hémoglobine.
- Fréquent : tachycardie.
- Peu fréquent : bradycardie.
- Fréquent : anémie, neutropénie.
- Peu fréquent : thrombocytopénie.
- Très fréquent : état vertigineux, maux de tête.
- Fréquent : dysgueusie, somnolence, léthargie, tremblement, sédation, hypoesthésie, migraine.
- Peu fréquent : diminution du niveau de conscience, trouble de l’attention, trouble de l’équilibre, dysarthrie.
- Rare : troubles cognitifs, dysfonctionnements moteurs.
- Inconnu : perte de la conscience.
- Peu fréquent : trouble de la vision, hyperémie oculaire, vision trouble, diminution de l’acuité visuelle.
- Rare : sensations oculaires anormales, photopsie.
- Peu fréquent : vertiges, acouphènes, inconfort auditif.
- Fréquent : dyspnée, douleur pharyngolaryngée.
- Peu fréquent : dépression respiratoire, syndrome d’apnée du sommeil.
- Inconnu : arrêt respiratoire.
- Très fréquent : nausée, vomissement.
- Fréquent : constipation, stomatite, sécheresse buccale, diarrhée, douleur abdominale, reflux gastro-oesophagien, inconfort gastrique, dyspepsie, douleur dentaire.
- Peu fréquent : iléus, ulcération buccale, hypoesthésie orale, inconfort oral, décoloration de la muqueuse buccale, trouble des tissus mous de la cavité buccale, glossodynie, bulles au niveau de la langue, douleur gingivale, ulcération de la langue, trouble au niveau de la langue, oesophagite, lèvres gercées, trouble dentaire.
- Rare : bulles au niveau de la muqueuse buccale, sécheresse labiale.
- Peu fréquent : rétention urinaire.
- Fréquent : prurit, hyperhydrose, éruption cutanée.
- Peu fréquent : sueurs froides, oedème facial, prurit généralisé, alopécie.
- Rare : onychorrhexis.
- Fréquent : myalgie, douleur dorsale.
- Peu fréquent : contractions musculaires, faiblesse musculaire.
- Rare : hypogonadisme.
- Fréquent : anorexie.
- Fréquent : candidose orale.
- Peu fréquent : pharyngite.
- Rare : pustule buccale.
- Fréquent : chute.
- Fréquent : hypotension, hypertension.
- Peu fréquent : bouffée vasomotrice, bouffée de chaleur.
- Très fréquent : réactions au site d’administration y compris saignements, douleur, ulcère, irritation, paresthésie, anesthésie, érythème, oedème, gonflement et vésicules.
- Fréquent : oedème périphérique, fatigue, asthénie, syndrome de sevrage, frissons.
- Peu fréquent : malaise, sensation de faiblesse, inconfort thoracique, sensation de ne pas être dans un état normal, sensation de nervosité, soif, sensation de froid, frissons, sensation de chaud.
- Peu fréquent : dilatation des voies biliaires.
- Fréquent : dépression, anxiété, syndrome confusionnel, insomnie.
- Peu fréquent : humeur euphorique, nervosité, hallucination, hallucination visuelle, changements de l’état mental, dépendance (toxicomanie), désorientation.
SURDOSAGE |
PHARMACODYNAMIE |
Groupe pharmacothérapeutique : analgésiques, opioïdes, dérivés de la phénylpipéridine (code ATC : N02AB03).
Le fentanyl, agoniste morphinomimétique pur, agit essentiellement sur le récepteur morphinique µ. Ses effets thérapeutiques principaux sont l’analgésie et la sédation. Les effets pharmacologiques secondaires sont la dépression respiratoire, la bradycardie, l’hypothermie, la constipation, le myosis, la dépendance physique et l’euphorie.
Les effets analgésiques du fentanyl sont liés à ses concentrations plasmatiques. En règle générale, les concentrations efficace et toxique augmentent parallèlement à l’augmentation de la tolérance aux morphiniques. Il existe une grande variation interindividuelle du taux de développement d’une tolérance morphinique. Par conséquent, la titration de la dose d’Effentora permettant d’obtenir l’effet recherché doit être réalisée pour chaque patient (cf Posologie et Mode d’administration).
Tous les agonistes des récepteurs morphiniques µ, y compris le fentanyl, induisent une dépression respiratoire dose-dépendante. Le risque de dépression respiratoire est moindre chez les patients qui reçoivent un traitement morphinique de fond, car ces patients développent une tolérance à la dépression respiratoire.
L’innocuité et l’efficacité d’Effentora ont été évaluées chez les patients prenant le médicament à l’apparition de l’accès douloureux paroxystique. L’utilisation préventive d’Effentora dans les épisodes douloureux prévisibles n’a pas été étudiée dans les études cliniques. Deux études cliniques croisées, randomisées, en double insu, ont été menées sur un total de 248 patients cancéreux présentant en moyenne 1 à 4 accès douloureux paroxystique(s) quotidien(s) alors qu’ils recevaient un traitement de fond morphinique. La détermination de la dose efficace d’Effentora a été réalisée lors d’une phase initiale de titration en ouvert. Les patients pour lesquels une dose efficace était établie participaient à la phase en double insu de l’étude. Le critère principal d’efficacité était l’évaluation de l’intensité de la douleur par le patient. Les patients ont évalué l’intensité de la douleur selon une échelle de 11 points. À chaque accès douloureux paroxystique, l’intensité de la douleur était évaluée avant et à différents points dans le temps après le traitement.
La titration d’une dose efficace a été possible chez 67 % des patients.
Dans l’étude clinique pivotale (étude 1), le critère principal d’évaluation a été la somme moyenne des différences des scores d’intensité douloureuse évaluée de la prise du traitement jusqu’à 60 minutes compris (SPID60). Cette valeur a été statistiquement significative par rapport au placebo (p < 0,0001).
| Étude 1 : différence moyenne d’intensité douloureuse (± ESM) à chaque point dans le temps (échantillon complet d’analyse) |
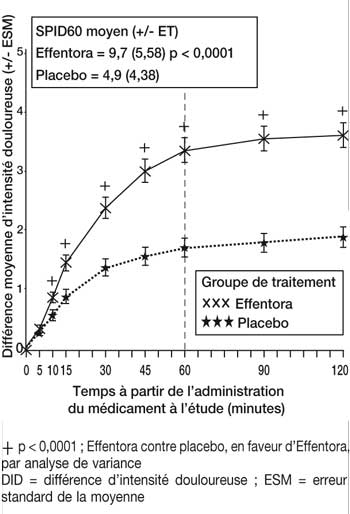 |
| Étude 2 : différence moyenne d’intensité douloureuse (± ESM) à chaque point dans le temps (échantillon complet d’analyse) |
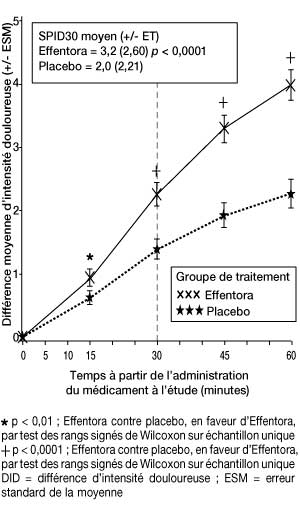 |
Dans la seconde étude pivotale (étude 2), le critère principal d’évaluation était SPID30. Cette valeur a également été statistiquement significative par rapport au placebo (p < 0,0001).
Le soulagement des accès douloureux paroxystiques induit par Effentora a été significativement supérieur à celui du placebo dès 10 minutes dans l’étude 1 et dès 15 minutes (évaluation la plus précoce) dans l’étude 2. Ces différences ont continué à être statistiquement significatives à chaque point dans le temps et dans chacune des deux études.
PHARMACOCINÉTIQUE |
- Généralités :
- Le fentanyl est une substance très lipophile et peut être absorbé très rapidement par la muqueuse buccale et plus lentement par la voie gastro-intestinale conventionnelle. Il subit un métabolisme par effet de premier passage hépatique et intestinal, mais ses métabolites ne contribuent pas à ses effets thérapeutiques.
- Effentora utilise une réaction effervescente pour délivrer la substance active, ce qui permet d’augmenter le taux et la proportion de fentanyl absorbé par la muqueuse buccale. La réaction effervescente est accompagnée de modifications transitoires du pH qui peuvent améliorer la dissolution (à un pH plus bas) ou la perméabilité membranaire (à un pH plus élevé).
- Le temps de présence du comprimé (défini comme étant la période de temps de désintégration totale du comprimé après administration orale) ne semble pas avoir d’influence sur l’exposition systémique précoce au fentanyl. Une étude comparative entre un comprimé d’Effentora à 400 µg administré soit par voie buccale (par exemple, entre la joue et la gencive) soit par voie sublinguale, a montré la bioéquivalence de deux voies d’administration.
- L’effet d’une insuffisance rénale ou hépatique sur la pharmacocinétique d’Effentora n’a pas été étudié.
- Absorption :
- Après administration par voie buccale transmuqueuse d’Effentora, le fentanyl est rapidement absorbé avec une biodisponibilité absolue de 65 %. Le profil d’absorption d’Effentora résulte largement d’une absorption initiale rapide à partir de la muqueuse buccale. Les prélèvements sanguins montrent que les concentrations plasmatiques maximales sont obtenues dans l’heure qui suit l’administration par voie buccale transmuqueuse. Environ 50 % de la dose totale administrée est rapidement absorbée par la voie transmuqueuse et devient disponible sur le plan systémique. Les 50 % restants de la dose totale sont ingérés et lentement absorbés à partir du tractus gastro-intestinal. Environ 30 % de la fraction ingérée (50 % de la dose totale) échappent à l’élimination lors du premier passage hépatique et intestinal et devient disponible sur le plan systémique.
- Le tableau ci-dessous illustre les principaux paramètres pharmacocinétiques.
-
Paramètres pharmacocinétiques* chez les sujets adultes recevant Effentora : Paramètre pharmacocinétique Effentora 400 µg Biodisponibilité absolue 65 % (± 20 %) Fraction absorbée par voie transmuqueuse 48 % (± 31,8 %) Tmax (minute)** 46,8 (20-240) Cmax (ng/ml) 1,02 (± 0,42) ASC0-tmax (ng × h/ml) 0,40 (± 0,18) ASC0-infini (ng × h/ml) 6,48 (± 2,98) -
*
Sur la base des échantillons sanguins veineux (plasma). Les concentrations du citrate de fentanyl obtenues dans le sérum étaient supérieures à celles du plasma. L’ASC et la Cmax ont été respectivement d’environ 20 % à 30 % supérieures à l’ASC et à la Cmax du plasma. La raison de cette différence n’est pas connue.
-
**
Valeurs médianes de Tmax (valeurs extrêmes).
- Lors d’études de pharmacocinétique comparant la biodisponibilité absolue et relative d’Effentora à celle du citrate de fentanyl par voie buccale transmuqueuse (OTFC), le taux et la fraction d’absorption du fentanyl d’Effentora se sont avérés avoir une exposition 30 % à 50 % supérieure à celle du citrate de fentanyl par voie buccale transmuqueuse. Chez les patients passant d’une autre forme orale de citrate de fentanyl à Effentora, la titration de la dose d’Effentora doit être réalisée indépendamment étant donné que la biodisponibilité entre les produits diffère significativement. Néanmoins, chez ces patients, une dose initiale supérieure à 100 µg peut être envisagée.
-
Concentrations plasmatiques moyennes dans le temps Profils après dose unique d’Effentora et OTFC* chez les sujets sains : 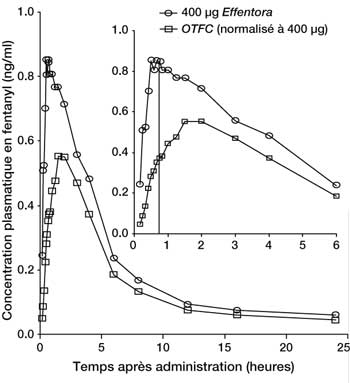
Les données d’OTFC ont été ajustées (800 µg à 400 µg)
* OTFC = citrate de fentanyl par voie buccale transmuqueuse. - Des différences d’exposition à Effentora ont été observées au cours d’une étude clinique chez des patients atteints de mucite de grade 1. La Cmax et l’ASC0-infini ont été respectivement 1 % et 25 % plus élevées chez les patients atteints de mucite par rapport à ceux qui n’étaient pas atteints. Les différences observées n’étaient pas cliniquement significatives.
- Distribution :
- Le fentanyl est une substance fortement lipophile qui présente une bonne distribution extravasculaire et un volume apparent de distribution élevé. Après administration buccale d’Effentora, le fentanyl subit une distribution initiale rapide qui représente une équilibration du fentanyl entre le plasma et les tissus fortement vascularisés (cerveau, coeur et poumons). Par la suite, le fentanyl est redistribué entre le compartiment tissulaire profond (tissus musculaires et adipeux) et le plasma.
- Le taux de liaison du fentanyl aux protéines plasmatiques est de 80 à 85 %. La principale protéine de liaison est l’alpha-1 glycoprotéine acide mais l’albumine et les lipoprotéines sont également impliquées, dans une certaine mesure. L’acidose augmente la fraction libre de fentanyl.
- Métabolisme :
- Les voies métaboliques empruntées par Effentora après administration buccale n’ont pas été déterminées lors des études cliniques. Le fentanyl est métabolisé en norfentanyl dans le foie et la muqueuse intestinale sous l’effet de l’isoenzyme 3A4 du cytochrome P450. Lors des expérimentations animales, le norfentanyl n’a pas montré d’effet pharmacologique. Plus de 90 % de la dose de fentanyl administrée sont éliminés par biotransformation en métabolites N-désalkylés et hydroxylés inactifs.
- Élimination :
- Après administration intraveineuse de fentanyl, moins de 7 % de la dose administrée est excrétée sous forme inchangée dans les urines et seul 1 % environ est excrété sous forme inchangée dans les selles. Les métabolites sont essentiellement excrétés par voie urinaire, l’excrétion fécale étant moins importante.
- Après administration d’Effentora, la phase terminale d’élimination du fentanyl résulte de la redistribution entre le plasma et un compartiment tissulaire profond. Cette phase d’élimination est lente et résulte en une demi-vie d’élimination terminale médiane t1/2 d’environ 22 heures après administration buccale de la forme effervescente et d’environ 18 heures après administration intraveineuse. La clairance plasmatique totale de fentanyl après administration intraveineuse est d’environ 42 l/h.
- Linéarité/non linéarité :
- Pour la gamme de dosages disponibles (100 à 1000 µg), les paramètres pharmacocinétiques du fentanyl sont dose-proportionnels.
SÉCURITE PRÉCLINIQUE |
Les données précliniques issues des études conventionnelles de pharmacologie de sécurité, de toxicologie en administration répétée de génotoxicité et de cancérogenèse n’ont pas mis en évidence de risque particulier.
Les études de toxicité sur le développement embryofoetal conduites chez le rat et le lapin n’ont révélé aucune malformation ou modification du développement lorsqu’Effentora était administré pendant la période d’organogenèse.
Dans une étude de fertilité et de développement embryonnaire précoce chez le rat, un effet médié par les mâles a été observé à forte dose (300 µg/kg/jour, voie sous-cutanée) qui concordait avec les effets sédatifs du fentanyl.
Dans les études de développement pré et postnatal chez le rat, le taux de survie de la descendance était significativement réduit à des doses entraînant une toxicité maternelle sévère. Les effets des doses toxiques maternelles sur la première génération sont : un retard du développement physique, des fonctions sensorielles, du réflexe et du comportement. Ces effets peuvent être des effets indirects de négligence maternelle et/ou de diminution de l’allaitement ou un effet direct du fentanyl.
Les études de cancérogénicité (test alternatif par voie cutanée chez la souris transgénique Tg.AC durant 26 semaines, étude de cancérogenèse par voie sous-cutanée chez le rat durant 2 ans) ne montrent pas de résultats suggérant un potentiel oncogène.
MODALITÉS DE CONSERVATION |
- Durée de conservation :
- 3 ans.
A conserver dans l’emballage extérieur d’origine à l’abri de l’humidité.
MODALITÉS MANIPULATION/ÉLIMINATION |
Il est impératif d’informer les patients et le personnel soignant d’éliminer, dès qu’ils ne sont plus nécessaires, tous les comprimés non utilisés au terme du traitement.
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM | EU/1/08/441/001 ; CIP 3400939220710 (4 cp 100 µg). |
| EU/1/08/441/002 ; CIP 3400939220888 (28 cp 100 µg). | |
| EU/1/08/441/003 ; CIP 3400939220949 (4 cp 200 µg). | |
| EU/1/08/441/004 ; CIP 3400939221021 (28 cp 200 µg). | |
| EU/1/08/441/006 ; CIP 3400939221250 (28 cp 400 µg). | |
| EU/1/08/441/008 ; CIP 3400939221489 (28 cp 600 µg). | |
| EU/1/08/441/010 ; CIP 3400939221601 (28 cp 800 µg). | |
| RCP révisés le 03.11.10. | |
| Prix : | 33.08 euros (4 comprimés à 100 µg). |
| 199.02 euros (28 comprimés à 100 µg). | |
| 33.08 euros (4 comprimés à 200 µg). | |
| 199.02 euros (28 comprimés à 200 µg). | |
| 199.02 euros (28 comprimés à 400 µg). | |
| 199.02 euros (28 comprimés à 600 µg). | |
| 199.02 euros (28 comprimés à 800 µg). | |
| Remb Séc soc à 65 %. Collect. | |
CEPHALON FRANCE
20, rue Charles-Martigny. 94700 Maisons-Alfort
Tél : 01 49 81 81 00
Info médic et scientifique :
Tél : 01 49 81 81 81
Liste Des Sections Les Plus Importantes :
- pathologies
- Medicaments
- Medicaments injectables
- Traitement D’Urgence
- Guide Infirmier Des Examens De Laboratoire
- Infirmiers En Urgences
- Fiche Technique Medical
- Techniques De Manipulations En Radiologie Medicale
- Bibliotheque_medicale



