FORMES et PRÉSENTATIONS |
COMPOSITION |
| Poudre* : | p cartouche |
| Atropine sulfate | 2 mg |
| Avizafone (DCI) chlorhydrate | 20 mg |
| Pralidoxime méthylsulfate | 350 mg |
Solvant : eau ppi.
* A reconstituer dans 2,5 ml d’eau ppi contenue dans le compartiment de solvant de la cartouche.
INDICATIONS |
POSOLOGIE ET MODE D’ADMINISTRATION |
Posologie :
Réservé à l’adulte à partir de 18 ans.
Auto-injection par voie intramusculaire dans la cuisse, dès l’apparition des premiers symptômes d’intoxication, de la dose contenue dans un dispositif.
En cas de persistance des symptômes d’intoxication, l’injection peut être renouvelée une fois uniquement, 15 minutes après la première injection.
La posologie à utiliser chez le sujet âgé ou en cas d’insuffisance rénale ou hépatique n’est pas connue.
Mode d’administration :
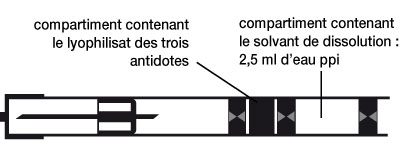
- Description du dispositif :
- L’auto-injecteur est un dispositif contenant dans un compartiment les 3 principes actifs sous forme lyophilisée et dans un autre compartiment le solvant (eau ppi).
- Le schéma suivant décrit l’auto-injecteur.
-
- Mode de reconstitution de la solution et injection :
- Le dispositif permet la reconstitution de la solution et son injection, en 2 temps successifs :
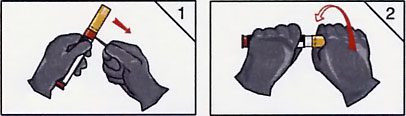
- Premier temps : reconstitution de la solution à injecter.
- Elle se fera sur ordre des autorités et/ou dès la notion de menace avérée d’intoxication, par vissage du système, après retrait de la sécurité de reconstitution, selon le schéma ci-joint.
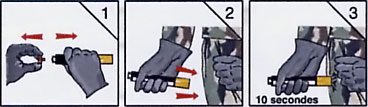
- Deuxième temps : injection intramusculaire après retrait de la sécurité d’injection, par pression sur le corps inférieur de l’auto-injecteur mis en contact de la face externe de la cuisse, à travers les vêtements, selon le schéma ci-dessous.
- Premier temps : reconstitution de la solution à injecter.
Note : en cas de risque avéré d’intoxication, sur ordre des autorités, un prétraitement par pyridostigmine sera démarré par voie orale à raison de 30 mg toutes les 8 heures.
CONTRE-INDICATIONS |
MISES EN GARDE et PRÉCAUTIONS D’EMPLOI |
L’efficacité du traitement est d’autant plus grande que l’injection est effectuée rapidement après les premiers signes d’intoxications (thérapeutique du premier quart d’heure).
- un syndrome cholinergique dont le tableau clinique est le suivant :
- syndrome muscarinique associant hypersécrétion salivaire et bronchique, sueurs profuses, myosis, bronchospasme, bradycardie, hypotension, douleurs abdominales et diarrhées, confusion et convulsions,
- syndrome nicotinique associant fasciculations musculaires puis paralysie musculaire périphérique et respiratoire ;
- syndrome muscarinique associant hypersécrétion salivaire et bronchique, sueurs profuses, myosis, bronchospasme, bradycardie, hypotension, douleurs abdominales et diarrhées, confusion et convulsions,
- un syndrome central : convulsions, état de mal, coma.
Mises en garde :
Ce médicament peut provoquer :
- une somnolence, une amnésie et des réactions paradoxales (liées à l’avizafone [benzodiazépine]) ;
- des troubles de la vision (liés au pralidoxime ou à l’atropine) ;
- des réactions d’hypersensibilité à l’un des trois constituants.
La prise d’alcool ou de médicaments contenant de l’alcool est déconseillée (cf Interactions).
Précautions d’emploi :Des précautions d’emploi doivent être prises dans les cas suivants :
Liées à l’avizafone :- chez le sujet âgé ;
- chez l’insuffisant rénal ou hépatique ;
- chez le sujet présentant des apnées du sommeil.
- antécédents de glaucome par fermeture de l’angle ;
- rétention urinaire liée à des troubles urétroprostatique, hypertrophie de la prostate ;
- hyperthyroïdie ;
- insuffisance respiratoire, rénale et/ou hépatique ;
- bronchite chronique ;
- iléus paralytique, atonie intestinale, mégacôlon toxique.
- chez l’insuffisant rénal et hépatique.
Néanmoins, dans le contexte d’urgence, seules les précautions d’emploi suivantes sont à respecter :
- Liées à l’avizafone : myasthénie.
- Liées à l’atropine : insuffisance coronarienne, troubles du rythme ventriculaires connus ; surveiller la fréquence cardiaque au décours des injections.
INTERACTIONS |
- Médicaments sédatifs :
- Il faut prendre en compte le fait que de nombreux médicaments ou substances peuvent additionner leurs effets dépresseurs du système nerveux central et contribuer à diminuer la vigilance. Il s’agit des dérivés morphiniques (analgésiques, antitussifs et traitements de substitution), des neuroleptiques, des barbituriques, des benzodiazépines, des anxiolytiques autres que les benzodiazépines (par exemple, le méprobamate), des hypnotiques, des antidépresseurs sédatifs (amitriptyline, doxépine, miansérine, mirtazapine, trimipramine), des antihistaminiques H1 sédatifs, des antihypertenseurs centraux, du baclofène et du thalidomide.
Déconseillées :
- Alcool : majoration par l’alcool de l’effet sédatif de ces substances. L’altération de la vigilance peut rendre dangereuses la conduite de véhicules et l’utilisation de machines. Éviter la prise de boissons alcoolisées et de médicaments contenant de l’alcool.
Nécessitant des précautions d’emploi :
- Cimétidine (avec la cimétidine utilisée à des doses >= 800 mg/j) : risque accru de somnolence. Avertir les patients de l’augmentation du risque en cas de conduite automobile ou d’utilisation de machines.
- Phénytoïne (et par extrapolation fosphénytoïne) : variations imprévisibles ; les concentrations plasmatiques de phénytoïne peuvent augmenter, avec signes de surdosage, mais aussi diminuer ou rester stables. Surveillance clinique et contrôle des concentrations plasmatiques de phénytoïne.
- Stiripentol : augmentation des concentrations plasmatiques du diazépam, avec risque de surdosage, par inhibition de son métabolisme hépatique. Surveillance clinique et dosage plasmatique, lorsque cela est possible, du diazépam associé au stiripentol.
A prendre en compte :
- Barbituriques : risque majoré de dépression respiratoire, pouvant être fatale en cas de surdosage.
- Buprénorphine (avec la buprénorphine utilisée en traitement de substitution) : risque majoré de dépression respiratoire, pouvant être fatale. Évaluer attentivement le rapport bénéfice/risque de cette association. Informer le patient de la nécessité de respecter les doses prescrites.
- Buspirone : risque de majoration des effets indésirables de la buspirone.
- Cisapride : majoration transitoire de l’effet sédatif du diazépam par augmentation de sa vitesse d’absorption. L’altération de la vigilance peut rendre dangereuses la conduite de véhicules et l’utilisation de machines.
- Clozapine : risque accru de collapsus avec arrêt respiratoire et/ou cardiaque.
- Morphiniques : risque majoré de dépression respiratoire, pouvant être fatale en cas de surdosage.
Liés à l’atropine :
- Médicaments atropiniques :
- Il convient de prendre en compte le risque lié à l’association d’un médicament à action atropinique (imipraminiques, neuroleptiques phénothiaziniques, antispasmodiques, certains antihistaminiques H1…) chez un patient traité par anticholinestérasique. Outre la possible diminution de l’effet thérapeutique de ce dernier, l’interruption brutale du traitement atropinique expose au risque de dévoiler alors les effets muscariniques du parasympathomimétique avec symptomatologie de type « crise cholinergique », pouvant se manifester notamment par des convulsions.
GROSSESSE et ALLAITEMENT |
En raison de la mise en jeu du pronostic vital, l’utilisation d’Ineurope est possible au cours de la grossesse quel qu’en soit le terme.
Allaitement :
En raison de la mise en jeu du pronostic vital, l’utilisation d’Ineurope est possible au cours de l’allaitement.
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
- Liés à l’avizafone :
-
- Sensation ébrieuse, ataxie.
- Asthénie, baisse de la vigilance, somnolence.
- Amnésie antérograde, troubles mnésiques.
- Réactions paradoxales (insomnie, cauchemars, irritabilité, agressivité, agitation, troubles du comportement, troubles de la conscience).
- Hypotonie musculaire.
- Éruptions cutanées, parfois prurigineuses.
- Très rares cas d’augmentation des transaminases et des phosphatases alcalines ainsi que des cas d’ictères.
- Sensation ébrieuse, ataxie.
- Liés à l’atropine :
-
- Sécheresse buccale.
- Diminution de la sécrétion lacrymale.
- Épaississement des sécrétions bronchiques.
- Tachycardie, palpitations.
- Constipation.
- Rétention d’urine.
- Troubles de l’accommodation.
- Excitabilité.
- Irritabilité, confusion mentale chez les personnes âgées.
- Sécheresse buccale.
- Liés à la pralidoxime :
-
- Troubles visuels : diplopie, vision floue.
- Malaises, vertiges, céphalées et tachycardie.
- Troubles visuels : diplopie, vision floue.
- Liés à la voie d’administration :
- Possibilité de douleur transitoire au point d’injection.
SURDOSAGE |
- l’avizafone : sommeil profond jusqu’au coma, signes de confusion mentale, léthargie, ataxie, hypotonie, hypotension, dépression respiratoire (le flumazénil est l’antidote) ;
- l’atropine : sécheresse buccale, mydriase, paralysie de l’accommodation, diminution des sécrétions et surtout tachycardie, agitation, confusion et hallucinations allant jusqu’au délire, dépression respiratoire ;
- la pralidoxime : la pralidoxime à doses très élevées pourrait aggraver le bloc neuromusculaire dû à l’organophosphoré.
PHARMACODYNAMIE |
Classe pharmacothérapeutique : tous autres médicaments [antidote] (code ATC : V03AB).
Ineurope est un antidote associant trois principes actifs : l’atropine, l’avizafone et la pralidoxime. Il exerce un effet antidote par effet cumulé de l’activité des trois principes actifs associé dans le médicament :- l’atropine, anticholinergique, actif sur les récepteurs muscariniques ;
- l’avizafone, prodrogue active sous forme de diazépam, anticonvulsivant ;
- la pralidoxime, réactivateur des cholinestérases (enzymes régulatrices de la transmission nerveuse) inhibées par les neurotoxiques.
PHARMACOCINÉTIQUE |
- Absorption :
-
- Atropine : après administration intramusculaire, les concentrations plasmatiques maximales sont atteintes en 6 minutes en moyenne.
- Diazépam : après administration intramusculaire d’avizafone (prodrogue), les concentrations plasmatiques de diazépam sont atteintes entre 30 et 60 minutes.
- Pralidoxime : après administration intramusculaire, les concentrations plasmatiques maximales sont atteintes en 25 à 60 minutes.
- Atropine : après administration intramusculaire, les concentrations plasmatiques maximales sont atteintes en 6 minutes en moyenne.
- Distribution :
-
- Atropine : distribution tissulaire rapide ; passage de la barrière hémato-encéphalique ; liaison aux protéines plasmatiques : 44% ; passage de la barrière placentaire et dans le lait maternel.
- Diazépam :
Volume de distribution de 1 à 2 l/kg ; liaison aux protéines plasmatiques : 95 à 98 %. - Passage de la barrière hémato-encéphalique ainsi que dans le plasma et le lait maternel.
- Pralidoxime : large diffusion dans le compartiment extracellulaire ; faible passage de la barrière hémato-encéphalique ; non liée aux protéines plasmatiques.
- Atropine : distribution tissulaire rapide ; passage de la barrière hémato-encéphalique ; liaison aux protéines plasmatiques : 44% ; passage de la barrière placentaire et dans le lait maternel.
- Métabolisme et élimination :
-
- Atropine : métabolisme hépatique ; élimination urinaire sous forme inchangée (un tiers) et sous forme de métabolites glucuroconjugués pour le reste ; demi-vie d’élimination plasmatique : 2 à 2,5 heures.
- Diazépam : métabolisme hépatique ; excrétion urinaire avec pourcentage négligeable (< 0,1 %) de produit inchangé ; demi-vie d’élimination plasmatique : 32 à 47 heures ; les deux métabolites principaux sont le desméthyldiazépam (demi-vie de 30 à 150 heures) et l’oxazépam tous les deux actifs ; ces métabolites sont éliminés dans les urines sous une forme inactive glucuroconjuguée. Après administration d’avizafone, seuls les métabolites connus du diazépam sont identifiés.
- Pralidoxime : métabolisme hépatique ; élimination urinaire rapide en quelques heures sous forme inchangée et de métabolites ; demi-vie d’élimination plasmatique de 1 à 3 heures.
- Atropine : métabolisme hépatique ; élimination urinaire sous forme inchangée (un tiers) et sous forme de métabolites glucuroconjugués pour le reste ; demi-vie d’élimination plasmatique : 2 à 2,5 heures.
SÉCURITE PRÉCLINIQUE |
Les résultats des études de sécurité précliniques, conduites avec l’association des trois principes actifs (ou avec Ineurope) sur plusieurs espèces animales, à des doses correspondant à 10 fois la dose thérapeutique maximale, ont révélé des effets en relation avec une exacerbation de l’activité pharmacodynamique de chacun des constituants. Aucune toxicité particulière n’a été mise en évidence avec l’association, par rapport aux données disponibles avec chacun des constituants.
INCOMPATIBILITÉS |
En l’absence d’études de compatibilité, ce médicament ne doit pas être mélangé avec d’autres médicaments.
MODALITÉS DE CONSERVATION |
- Durée de conservation :
- 4 ans à partir de la fabrication du lyophilisat.
A conserver à une température comprise entre + 2 °C et + 8 °C.
- Après reconstitution :
- A conserver maximum 6 mois.
MODALITÉS MANIPULATION/ÉLIMINATION |
A reconstituer sur ordre des autorités et/ou dès la notion de menace avérée d’intoxication.
A utiliser dès apparition des premiers symptômes d’intoxication.
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM | 3400938416800 (2008, RCP rév 13.10.2009). |
| Non remboursable et non agréé Collect à la date du 30.06.2010 (demandes à l’étude). |
PHARMACIE CENTRALE DES ARMÉES
TSA 30004. 45404 Fleury-les-Aubrais cdx
Pharmacovigilance : Tél : 02 38 60 73 56
Tél 24 h/24 : 02 38 60 72 12
Liste Des Sections Les Plus Importantes :
- pathologies
- Medicaments
- Medicaments injectables
- Traitement D’Urgence
- Guide Infirmier Des Examens De Laboratoire
- Infirmiers En Urgences
- Fiche Technique Medical
- Techniques De Manipulations En Radiologie Medicale
- Bibliotheque_medicale



