FORMES et PRÉSENTATIONS |
COMPOSITION |
| Poudre : | p seringue |
| Leuproréline (DCI) acétate | 7,5 mg |
| ou | 22,5 mg |
| ou | 45 mg |
| (soit en leuproréline : 6,96 mg/ser 7,5 mg ; 20,87 mg/ser 22,5 mg ; 41,7 mg/ser 45 mg) | |
INDICATIONS |
POSOLOGIE ET MODE D’ADMINISTRATION |
- Homme adulte :
- Eligard 7,5 mg est administré une fois par mois en injection sous-cutanée unique, Eligard 22,5 mg une fois tous les 3 mois en injection sous-cutanée unique, et Eligard 45 mg tous les 6 mois en injection sous-cutanée unique. La solution injectée forme un dépôt médicamenteux solide et assure une libération continue d’acétate de leuproréline pendant un mois pour Eligard 7,5 mg, pendant 3 mois pour Eligard 22,5 mg, et pendant 6 mois pour Eligard 45 mg.
- Coût du traitement journalier : 4,14 euro(s) (7,5 mg) ; 3,70 euro(s) (22,5 mg) ; 3,51 euro(s) (45 mg).
- En règle générale, le traitement du cancer avancé de la prostate par Eligard doit être poursuivi à long terme et ne doit pas être interrompu en cas de rémission ou d’amélioration.
- La réponse au traitement par Eligard doit être surveillée en procédant à des examens cliniques et à l’analyse des taux sériques de l’antigène spécifique de la prostate (PSA). Des études cliniques ont montré que la testostéronémie augmentait au cours des 3 premiers jours de traitement chez la plupart des patients non orchidectomisés et diminuait ensuite en 3 à 4 semaines pour atteindre des valeurs inférieures aux taux de castration médicale. Une fois atteints, ces taux se maintiennent aussi longtemps que le traitement est poursuivi (remontées transitoires de testostérone < 1 %). Dans le cas où la réponse d’un patient paraît être suboptimale, il faut s’assurer que la testostéronémie a atteint des taux de castration ou qu’elle se maintient à ces taux.
- Enfant et adolescent :
- Il n’y a pas d’expérience chez l’enfant (âgé de moins de 18 ans) : cf Contre-indications.
- Ajustement posologique chez certaines populations particulières de patients :
- Aucune étude clinique n’a été réalisée chez les patients atteints d’insuffisance hépatique ou rénale.
Mode d’administration :
Le contenu des deux seringues stériles préremplies doit être mélangé juste avant l’administration d’Eligard par injection sous-cutanée.
Pour la procédure de mélange, cf rubrique Modalités manipulation/Élimination.
Au vu des données chez l’animal, une injection intra-artérielle ou intraveineuse doit absolument être évitée.
Comme pour les autres médicaments administrés par injection sous-cutanée, il est recommandé de changer régulièrement de site d’injection.
CONTRE-INDICATIONS |
- Hypersensibilité à l’acétate de leuproréline, aux autres agonistes de la GnRH ou à l’un des excipients.
- Chez les patients ayant subi précédemment une orchidectomie (comme avec les autres agonistes de la GnRH, Eligard n’entraîne pas de diminution additionnelle du taux de testostérone sérique dans le cas de castration chirurgicale).
- En monothérapie chez les patients atteints de cancer de la prostate avec compression médullaire ou métastases vertébrales (cf Mises en garde/Précautions d’emploi).
- Chez les femmes et les enfants.
MISES EN GARDE et PRÉCAUTIONS D’EMPLOI |
Mises en garde :
L’acétate de leuproréline, comme les autres agonistes de la GnRH, entraîne une élévation transitoire des concentrations sériques de testostérone, de dihydrotestostérone et des phosphatases acides pendant la première semaine de traitement. Les patients peuvent ressentir une aggravation des symptômes ou voir apparaître de nouveaux symptômes tels que douleurs osseuses, neuropathie, hématurie, obstruction urétérale ou vésicale (cf Effets indésirables). Ces symptômes cèdent habituellement à la poursuite du traitement.
L’administration associée d’un anti-androgène approprié doit être envisagée trois jours avant le traitement par leuproréline et poursuivie pendant les deux à trois premières semaines de traitement. Il a été observé que ces modalités permettent de prévenir les conséquences d’une augmentation initiale de testostérone sérique.
Après castration chirurgicale, Eligard n’entraîne pas de diminution supplémentaire de la testostéronémie chez les sujets masculins.
Des cas d’obstruction urétérale et de compression médullaire susceptibles d’entraîner une paralysie avec ou sans complications fatales, ont été rapportés avec les agonistes de la GnRH. L’apparition d’une compression médullaire ou d’une insuffisance rénale impose l’instauration d’un traitement standard de ces complications.
Les patients ayant des métastases vertébrales et/ou cérébrales ainsi que les patients ayant une obstruction des voies urinaires devront être étroitement surveillés pendant les premières semaines de traitement.
Un certain nombre de patients auront une tumeur qui ne sera pas sensible à un traitement hormonal. L’absence d’amélioration clinique malgré une baisse adéquate du taux de testostérone en est un indicateur. Dans ce cas, il est inutile de poursuivre le traitement par Eligard.
Une diminution de la densité osseuse a été rapportée dans la littérature médicale chez les hommes ayant subi une orchidectomie ou ayant été traités par un agoniste de la GnRH (cf Effets indésirables).
Le traitement anti-androgène augmente de façon significative le risque de fractures secondaires à une ostéoporose. Il n’existe qu’un nombre limité de données à ce sujet. Des fractures secondaires à une ostéoporose ont été observées chez 5 % des patients après 22 mois de traitement pharmacologique androgénosuppresseur et chez 4 % des patients après 5 à 10 ans de traitement. Le risque de fractures d’origine ostéoporotique est généralement plus élevé que le risque de fractures pathologiques.
En dehors d’un déficit prolongé en testostérone, un âge avancé, le tabagisme et la consommation de boissons alcoolisées, l’obésité et l’insuffisance d’exercice physique peuvent aussi favoriser le développement d’une ostéoporose.
Lors de la surveillance après la commercialisation, de rares cas d’apoplexie pituitaire (un syndrome clinique secondaire à un infarctus de la glande pituitaire) ont été rapportés après l’administration d’agonistes de la GnRH, la majorité survenant dans les 2 semaines suivant la première administration, et certaines dans la première heure. Dans ces cas, l’apoplexie pituitaire s’est manifestée sous la forme d’une céphalée soudaine, de vomissements, de troubles de la vision, d’ophtalmoplégie, d’un état mental altéré, et parfois d’un collapsus cardiovasculaire. Une prise en charge médicale immédiate est requise.
Précautions d’emploi :Des variations de la tolérance au glucose ont été rapportées chez certains patients bénéficiant d’un traitement par un agoniste de la GnRH. Un suivi plus fréquent est recommandé chez les patients diabétiques traités par Eligard.
INTERACTIONS |
GROSSESSE et ALLAITEMENT |
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
- Effets indésirables dans les études cliniques avec Eligard :
- Infections et infestations :
- Fréquent : rhinopharyngite.
- Peu fréquent : infection des voies urinaires, infection cutanée locale.
- Fréquent : rhinopharyngite.
- Troubles du métabolisme et de la nutrition :
- Peu fréquent : diabète sévère.
- Peu fréquent : diabète sévère.
- Affections psychiatriques :
- Peu fréquent : cauchemars, dépression, diminution de la libido.
- Peu fréquent : cauchemars, dépression, diminution de la libido.
- Affections du système nerveux :
- Peu fréquent : vertige, céphalée, hypoesthésie, insomnie, troubles du goût et de l’odorat.
- Rare : mouvements anormaux et involontaires.
- Peu fréquent : vertige, céphalée, hypoesthésie, insomnie, troubles du goût et de l’odorat.
- Affections vasculaires :
- Très fréquent : bouffées de chaleur.
- Peu fréquent : hypertension, hypotension.
- Rare : syncope et collapsus.
- Très fréquent : bouffées de chaleur.
- Affections respiratoires, thoraciques et médiastinales :
- Peu fréquent : rhinorrhée, dyspnée.
- Peu fréquent : rhinorrhée, dyspnée.
- Affections gastro-intestinales :
- Fréquent : nausées, diarrhée.
- Peu fréquent : constipation, bouche sèche, dyspepsie, vomissements.
- Rare : flatulence, éructation.
- Fréquent : nausées, diarrhée.
- Affections de la peau et du tissu sous-cutané :
- Très fréquent : ecchymoses, érythème.
- Fréquent : prurit, sudation nocturne.
- Peu fréquent : sueur froide, hypersudation.
- Rare : alopécie, éruption cutanée.
- Très fréquent : ecchymoses, érythème.
- Affections musculosquelettiques et systémiques :
- Fréquent : arthralgie, douleur des membres, myalgie.
- Peu fréquent : dorsalgie, crampe musculaire.
- Fréquent : arthralgie, douleur des membres, myalgie.
- Affections du rein et des voies urinaires :
- Fréquent : diminution de la fréquence de miction, miction difficile, dysurie, nycturie, oligurie.
- Peu fréquent : spasmes de la vessie, hématurie, aggravation de la fréquence urinaire, rétention urinaire.
- Fréquent : diminution de la fréquence de miction, miction difficile, dysurie, nycturie, oligurie.
- Affections des organes de reproduction et du sein :
- Fréquent : sensibilité mammaire, atrophie testiculaire, douleur testiculaire, stérilité, hypertrophie mammaire.
- Peu fréquent : gynécomastie, impuissance, troubles testiculaires.
- Rare : douleur mammaire.
- Fréquent : sensibilité mammaire, atrophie testiculaire, douleur testiculaire, stérilité, hypertrophie mammaire.
- Troubles généraux et anomalies au site d’administration :
- Très fréquent : fatigue, brûlure au site d’injection, paresthésie au site d’injection.
- Fréquent : malaise, douleur au site d’injection, hématome au site d’injection, picotements au site d’injection, rigidités, faiblesse.
- Peu fréquent : prurit au site d’injection, léthargie, douleur, fièvre.
- Rare : ulcération au site d’injection.
- Très rare : nécrose au site d’injection.
- Très fréquent : fatigue, brûlure au site d’injection, paresthésie au site d’injection.
- Affections hématologiques et du système lymphatique :
- Fréquent : perturbations hématologiques.
- Fréquent : perturbations hématologiques.
- Investigations :
- Fréquent : augmentation de la créatinine phosphokinase sanguine, prolongation du temps de coagulation.
- Peu fréquent : augmentation de l’alanine aminotransférase, augmentation des triglycérides sanguins, augmentation du temps de prothrombine, prise de poids.
- Fréquent : augmentation de la créatinine phosphokinase sanguine, prolongation du temps de coagulation.
- D’autres événements indésirables ont été rapportés en général dans le cas d’un traitement par l’acétate de leuproréline, incluant : oedème périphérique, embolie pulmonaire, palpitations, myalgie (Eligard 7,5 mg et 22,5 mg), hypotonie musculaire, frissons, dyspnée (Eligard 22,5 mg), vertiges d’origine périphérique, éruption cutanée, amnésie et troubles de la vision. Un infarctus d’une apoplexie pituitaire préexistante a été rarement décrit après administration d’un traitement par agoniste de la GnRH, qu’il soit à action immédiate ou prolongée. De rares cas de leucopénie et de thrombopénie ont été signalés. Des modifications de la tolérance au glucose ont été rapportées.
- Les événements indésirables locaux rapportés après injection d’Eligard sont similaires à ceux fréquemment (pour Eligard 22,5 mg) associés à des produits similaires injectés par voie sous-cutanée.
- Généralement, ces événements indésirables localisés survenant après une injection sous-cutanée sont légers et décrits comme étant de courte durée.
- Variations de la densité osseuse :
- Une diminution de la densité osseuse a été rapportée dans la littérature médicale chez les hommes ayant bénéficié d’une orchidectomie ou ceux traités par un agoniste de la GnRH. Il est probable qu’un traitement à long terme par la leuproréline révèle des signes d’aggravation d’ostéoporose, en ce qui concerne l’augmentation du risque de fracture d’origine ostéoporotique (cf Mises en garde/Précautions d’emploi).
- Accentuation des signes et symptômes de la maladie :
- Le traitement par l’acétate de leuproréline peut entraîner une accentuation des signes et symptômes de la maladie au cours des premières semaines de traitement. Une aggravation des affections, telles que métastases vertébrales et/ou obstruction urinaire ou hématurie, peut faire apparaître des problèmes neurologiques tels que faiblesse et/ou paresthésies des membres inférieurs ou une accentuation des symptômes urinaires.
SURDOSAGE |
PHARMACODYNAMIE |
Classe pharmacothérapeutique : analogues de l’hormone entraînant la libération de gonadotrophines (code ATC : L02AE02).
L’acétate de leuproréline est un nonapeptide de synthèse, agoniste de l’hormone naturelle de libération des gonadotrophines (GnRH) qui, en cas d’administration prolongée, entraîne une inhibition de la sécrétion des gonadotrophines hypophysaires et une suppression de la synthèse des stéroïdes testiculaires chez l’homme. Cet effet est réversible à l’arrêt du traitement médicamenteux. Cependant, l’agoniste possède une action plus puissante que l’hormone naturelle et le temps nécessaire pour restaurer les taux de testostérone peut varier selon les patients.
L’administration d’acétate de leuproréline entraîne une élévation initiale des taux circulants d’hormones lutéinisantes (LH) et d’hormones de stimulation folliculaire (FSH), responsables d’une élévation transitoire chez l’homme des concentrations de stéroïdes d’origine gonadique, testostérone et dihydrotestostérone. L’administration continue d’acétate de leuproréline entraîne une diminution des taux de LH et de FSH. Chez l’homme, la testostérone diminue en dessous du seuil de castration (<= 50 ng/dl).
Ces diminutions apparaissent trois à cinq semaines (pour Eligard 7,5 mg et Eligard 22,5 mg) ou trois à quatre semaines (pour Eligard 45 mg) après l’instauration du traitement. Les taux moyens de testostérone à six mois sont : 6,1 ng/dl (± 0,4) pour Eligard 7,5 mg, 10,1 ng/dl (± 0,7) pour Eligard 22,5 mg, et 10,4 ng/dl (± 0,53) pour Eligard 45 mg, comparables aux taux observés après orchidectomie bilatérale.
La testostéronémie de tous les patients qui ont reçu la dose de 7,5 mg de leuproréline dans l’étude clinique pivotale a atteint des taux de castration à 6 semaines ; 94 % l’ont atteint à J28 et 98 % à J35.
La testostéronémie de tous les patients qui ont reçu la dose de 22,5 mg de leuproréline dans l’étude clinique pivotale a atteint des taux de castration à 5 semaines ; 99 % l’ont atteint à J28.
La testostéronémie de tous les patients, sauf un, qui ont reçu la dose de 45 mg de leuproréline dans l’étude clinique pivotale a atteint des taux de castration à 4 semaines.
Chez la grande majorité des patients, les taux de testostérone étaient en dessous de 20 ng/dl ; le bénéfice clinique de ces taux faibles n’a pas encore été établi. Les taux de PSA diminuent, après six mois, de : 94 % pour Eligard 7,5 mg, 98 % pour Eligard 22,5 mg, et 97 % pour Eligard 45 mg.
Des études à long terme ont montré que la poursuite du traitement maintenait la testostéronémie à des valeurs inférieures au seuil de castration pendant une période allant jusqu’à 7 ans et probablement indéfiniment.
La taille de la tumeur n’a pas été mesurée directement pendant le programme d’étude clinique mais on a observé une réponse indirecte de la tumeur comme l’indique une réduction de 94 % du taux moyen de PSA avec Eligard 7,5 mg, de 98 % du taux moyen de PSA avec Eligard 22,5 mg, et de 97 % du taux moyen de PSA avec Eligard 45 mg.
PHARMACOCINÉTIQUE |
- Absorption :
- Chez les patients atteints d’un cancer avancé de la prostate, les concentrations sériques moyennes de leuproréline augmentent après l’injection initiale et atteignent 25,3 ng/ml après 4 à 8 heures (Cmax) pour Eligard 7,5 mg, 127 ng/ml après 4,6 heures (Cmax) pour Eligard 22,5 mg, et 82 ng/ml après 4,4 heures (Cmax) pour Eligard 45 mg.
- Après l’augmentation initiale survenant après chaque injection (phase plateau observée après chaque injection du 2e au 28e jour pour Eligard 7,5 mg, du 3e au 84e jour pour Eligard 22,5 mg, et du 3e au 168e jour pour Eligard 45 mg), les concentrations sériques restent relativement constantes (0,28 à 1,67 ng/ml pour Eligard 7,5 mg, et 0,2 à 2 ng/ml pour Eligard 22,5 mg et Eligard 45 mg). Il n’existe aucun élément indiquant une accumulation au cours de l’administration répétée.
- Distribution :
- Le volume moyen de distribution de la leuproréline à l’état d’équilibre après une administration intraveineuse en bolus à des volontaires sains de sexe masculin était de 27 litres. In vitro, la liaison aux protéines plasmatiques humaines varie entre 43 % et 49 %.
- Élimination :
- Chez des volontaires sains de sexe masculin, l’administration intraveineuse en bolus de 1 mg d’acétate de leuproréline a entraîné une clairance systémique moyenne de 8,34 l/h, avec une demi-vie d’élimination terminale d’environ 3 heures selon un modèle à deux compartiments.
- Aucune étude d’excrétion du médicament n’a été réalisée avec Eligard.
- Aucune étude sur le métabolisme d’Eligard n’a été réalisée.
SÉCURITE PRÉCLINIQUE |
Les études précliniques avec l’acétate de leuproréline ont montré des effets sur le système de reproduction des deux sexes, effets attendus compte tenu du profil pharmacologique connu du principe actif. Ces effets se sont révélés réversibles après l’arrêt du traitement et une période appropriée de régénération. L’acétate de leuproréline n’a pas révélé d’activité tératogène. Une embryotoxicité/létalité a été observée chez le lapin, liée aux effets pharmacologiques de l’acétate de leuproréline sur le système reproductif.
Des études de cancérogénicité ont été réalisées chez le rat et la souris pendant 24 mois. Chez le rat, une augmentation dose-dépendante des apoplexies pituitaires a été observée après administration sous-cutanée aux doses de 0,6 à 4 mg/kg/jour. Aucun effet de ce type n’a été observé chez la souris.
L’acétate de leuproréline et la formulation 1 mois Eligard 7,5 mg ne se sont pas révélés mutagènes lors de tests réalisés in vitro et in vivo.
INCOMPATIBILITÉS |
La leuproréline contenue dans la seringue B doit être mélangée uniquement avec le solvant de la seringue A et ne doit pas être mélangée à d’autres médicaments.
CONDITIONS DE CONSERVATION |
A conserver au réfrigérateur (entre 2 °C et 8 °C), dans l’emballage extérieur d’origine, à l’abri de l’humidité.
Après première ouverture du plateau (pour le conditionnement en plateau) ou du grand sachet externe en aluminium (pour le conditionnement en sachet), la poudre et le solvant pour solution injectable doivent être immédiatement utilisés pour reconstituer le médicament et l’administrer au patient.
Après reconstitution : Administrer le produit immédiatement, la viscosité de la solution augmentant avec le temps.
MODALITÉS MANIPULATION/ÉLIMINATION |
Laisser le produit se réchauffer à température ambiante.
Préparer en premier le patient pour l’injection, puis la préparation du produit, en suivant les instructions ci-dessous (les images des seringues et de l’aiguille ne reflètent pas leur taille réelle).
- Ouvrir le sachet d’emballage ou le plateau (déchirer le papier aluminium par le coin reconnaissable par une petite bulle) et vider le contenu sur un plan de travail propre (deux sachets ou plateaux contenant la seringue A [figure 1.1] et la seringue B [figure 1.2]). Jeter les dessicants.
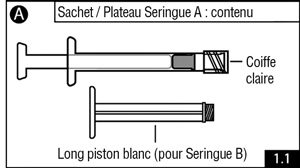
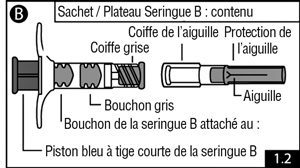
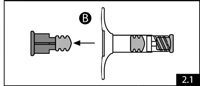
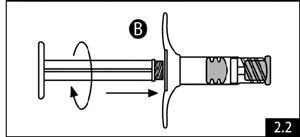
- Retirer le piston bleu à tige courte (ne pas dévisser) et le bouchon de la seringue B et jeter ce dernier (figure 2.1). Visser doucement le long piston blanc au bouchon gris restant dans la seringue B (figure 2.2).
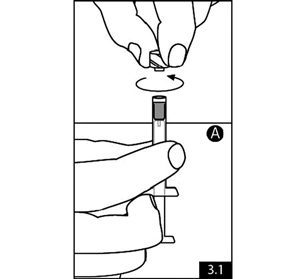
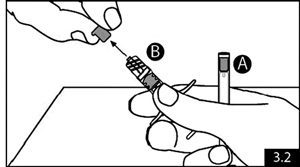
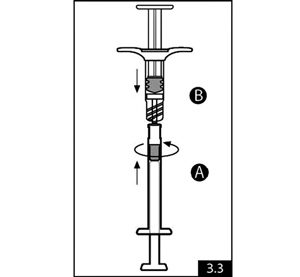
- Tenir la seringue A en position verticale pour s’assurer que le liquide ne fuit pas et dévisser la coiffe claire de la seringue A (figure 3.1). Retirer la coiffe grise de la seringue B (figure 3.2). Relier les deux seringues l’une à l’autre en poussant et en tournant jusqu’à la sécurité (figure 3.3). Ne pas trop serrer. L’aiguille ne sera pas correctement sécurisée si du liquide fuit.
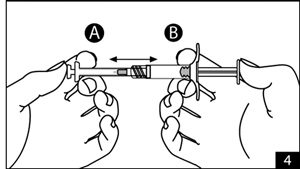
- Injecter le liquide contenu dans la seringue A dans la seringue B contenant l’acétate de leuproréline. Mélanger parfaitement le produit en poussant et tirant alternativement, doucement, les pistons des deux seringues (environ une soixantaine de fois au total) en position horizontale pour obtenir une solution homogène (figure 4). Ne pas incliner le système des seringues. Parfaitement mélangée, la solution apparaîtra visqueuse avec une gamme couleur allant de l’incolore à blanc, et à jaune pâle (ce qui inclut toutes les nuances du blanc au jaune pâle). Le produit doit être mélangé comme décrit ; le secouer ne mélangera pas le produit correctement.
- Tenir les seringues en position verticale, la seringue B étant en bas. Les seringues doivent rester bien assemblées. Prélever tout le produit mélangé de la seringue B (la seringue large et courte) en abaissant le piston de la seringue A et en retirant légèrement le piston de la seringue B. Séparer la seringue A en continuant à pousser sur le piston de la seringue A (figure 5). S’assurer que le produit ne fuit pas car l’aiguille ne sera pas correctement sécurisée. Il restera des petites bulles d’air dans la préparation. Ceci n’est pas gênant.
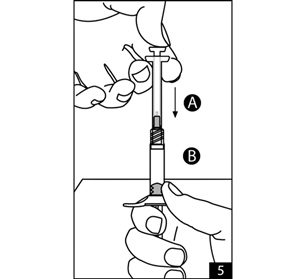
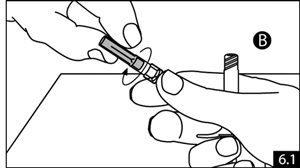
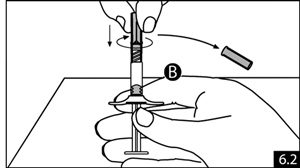
- Tenir la seringue B droite. Enlever la coiffe de l’aiguille stérile en la faisant tourner (figure 6.1). Fixer l’aiguille à l’extrémité de la seringue B (figure 6.2) en poussant doucement et en tournant l’aiguille jusqu’à ce qu’elle soit solidement mise en place. Ne pas trop serrer. Retirer la protection de l’aiguille avant administration.
- Une fois le produit reconstitué, l’administrer immédiatement, la viscosité de la solution augmentant avec le temps. A usage unique. Toute solution non utilisée doit être éliminée.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM | 3400936690868 (2005 rév 04.08.2009) 7,5 mg (sachets ou plateaux). |
| 3400936690929 (2005 rév 04.08.2009) 22,5 mg (sachets ou plateaux). | |
| 3400938263381 (2007 rév 04.08.2009) 45 mg (plateaux). |
| Prix : | 124.11 euros (solution injectable à 7,5 mg). |
| 332.96 euros (solution injectable à 22,5 mg). | |
| 632.55 euros (solution injectable à 45 mg). | |
| Remb Séc soc à 100 %. Collect. | |
ASTELLAS PHARMA
114, rue Victor-Hugo. 92300 Levallois-Perret
Tél : 01 55 91 75 00. Fax : 01 55 91 75 69
Liste Des Sections Les Plus Importantes :
- pathologies
- Medicaments
- Medicaments injectables
- Traitement D’Urgence
- Guide Infirmier Des Examens De Laboratoire
- Infirmiers En Urgences
- Fiche Technique Medical
- Techniques De Manipulations En Radiologie Medicale
- Bibliotheque_medicale



