époétine alfa
FORMES et PRÉSENTATIONS |
COMPOSITION |
| p seringue | |
| Époétine alfa* (DCI) : | |
|
– 1000 UI/0,5 ml | 8,4 µg |
|
– 2000 UI/0,5 ml | 16,8 µg |
|
– 3000 UI/0,3 ml | 25,2 µg |
|
– 4000 UI/0,4 ml | 33,6 µg |
|
– 5000 UI/0,5 ml | 42,0 µg |
|
– 6000 UI/0,6 ml | 50,4 µg |
|
– 8000 UI/0,8 ml | 67,2 µg |
|
– 10 000 UI/1 ml | 84 µg |
INDICATIONS |
- Traitement de l’anémie symptomatique associée à une insuffisance rénale chronique (IRC) chez l’adulte et l’enfant :
- Traitement de l’anémie secondaire à une insuffisance rénale chronique chez les enfants et les patients adultes hémodialysés et les patients adultes en dialyse péritonéale.
- Traitement de l’anémie sévère d’origine rénale accompagnée de symptômes cliniques chez les patients adultes insuffisants rénaux non encore dialysés.
- Traitement de l’anémie secondaire à une insuffisance rénale chronique chez les enfants et les patients adultes hémodialysés et les patients adultes en dialyse péritonéale.
- Traitement de l’anémie et réduction des besoins transfusionnels chez les patients adultes traités par chimiothérapie pour des tumeurs solides, des lymphomes malins ou des myélomes multiples et à risque de transfusion en raison de leur état général (par exemple état cardiovasculaire, anémie préexistante au début de la chimiothérapie).
- Eprex peut être utilisé pour augmenter les dons de sang autologue chez des malades participant à un programme de transfusions autologues différées. L’utilisation dans cette indication doit tenir compte du risque accru d’accidents thromboemboliques.
- Le traitement est indiqué chez les malades présentant une anémie modérée (Hb : 10 à 13 g/dl, soit 6,21 à 8,07 mmol/l) et sans carence martiale, s’il n’existe pas ou peu de méthodes d’épargne du sang lorsqu’une intervention chirurgicale programmée importante nécessite de grandes quantités de sang (4 unités de sang ou plus chez les femmes et 5 unités de sang ou plus chez les hommes).
- Eprex peut être utilisé pour réduire l’exposition aux transfusions de sang homologue chez les patients adultes, sans carence martiale, devant subir une intervention chirurgicale orthopédique majeure programmée, ayant un risque présumé important de complications transfusionnelles. L’utilisation devra être réservée aux patients ayant une anémie modérée (par exemple Hb : 10 à 13 g/dl), qui n’ont pas accès à un programme de prélèvement autologue différé et chez lesquels on s’attend à des pertes de sang modérées (900 à 1800 ml).
POSOLOGIE ET MODE D’ADMINISTRATION |
- Traitement de l’anémie symptomatique chez l’adulte et l’enfant en insuffisance rénale chronique :
- Chez les patients en insuffisance rénale chronique dont l’accès à la voie intraveineuse est déjà disponible (patients hémodialysés), l’administration d’Eprex par voie intraveineuse est préférable. Lorsque l’accès à la voie intraveineuse n’est pas encore disponible (patients non encore dialysés et patients en dialyse péritonéale), Eprex peut être administré par voie sous-cutanée.
- Les symptômes et conséquences de l’anémie peuvent varier avec l’âge, le sexe et les comorbidités ; une évaluation par le médecin de l’état de santé et de l’évolution clinique du patient est nécessaire.
- Eprex doit être administré afin d’augmenter l’hémoglobine à un taux ne dépassant pas 12 g/dl (7,5 mmol/l). Une augmentation du taux d’hémoglobine supérieure à 2 g/dl (1,25 mmol/l) sur une période de quatre semaines doit être évitée. Si cela se produit, un ajustement approprié de la dose doit être réalisé, comme indiqué.
- En raison de la variabilité intra-patient, des valeurs individuelles et occasionnelles du taux d’hémoglobine au-dessus et au-dessous du taux d’hémoglobine désiré peuvent être observées chez un même patient. La variabilité du taux d’hémoglobine doit être prise en compte par l’adaptation de la posologie en tenant compte de l’intervalle cible d’hémoglobine de 10 g/dl (6,2 mmol/l) à 12 g/dl (7,5 mmol/l). Chez les enfants, l’intervalle cible d’hémoglobine recommandé est compris entre 9,5 et 11 g/dl (5,9 – 6,8 mmol/l).
- Un taux d’hémoglobine prolongé supérieur à 12 g/dl (7,5 mmol/l) doit être évité. Si le taux d’hémoglobine augmente de plus de 2 g/dl (1,25 mmol/l) par mois, ou si le taux d’hémoglobine prolongé dépasse 12 g/dl (7,5 mmol/l), réduire la dose d’époétine alfa de 25 %. Si le taux d’hémoglobine dépasse 13 g/dl (8,1 mmol/l), interrompre le traitement jusqu’à ce que le taux s’abaisse en dessous de 12 g/dl (7,5 mmol/l) et reprendre le traitement par époétine alfa à une dose de 25 % inférieure à la dose précédente.
- Les patients doivent être étroitement surveillés afin de s’assurer que la plus faible dose d’Eprex soit utilisée pour obtenir un contrôle adéquat de l’anémie et des symptômes de l’anémie.
- L’état des réserves en fer devra être évalué avant et pendant le traitement, et une supplémentation en fer doit être administrée en cas de besoin. Par ailleurs, avant de commencer le traitement par époétine alfa, il faut éliminer d’autres causes d’anémies, telles qu’un déficit en vitamine B12 ou en folate. L’absence de réponse au traitement par époétine alfa doit en faire rechercher les causes. Celles-ci peuvent être : déficits en fer, folate ou vitamine B12 ; intoxication par l’aluminium ; infections intercurrentes ; syndromes inflammatoires ou traumatismes ; saignements occultes ; hémolyse et fibrose médullaire de quelque origine qu’elles soient.
- Adulte en hémodialyse :
- Chez les patients adultes en hémodialyse, lorsque la voie intraveineuse est déjà disponible, l’administration par la voie intraveineuse est préférable.
- Le traitement est divisé en deux phases :
- Phase correctrice :
50 UI/kg 3 fois par semaine. Si un ajustement des doses est nécessaire, il est recommandé de procéder par paliers d’au moins 4 semaines. A chaque palier, l’augmentation ou la diminution de dose préconisée est de 25 UI/kg 3 fois par semaine. - Phase d’entretien :
La posologie est ajustée pour maintenir l’hémoglobine au taux désiré : Hb entre 10 et 12 g/dl (6,2 à 7,5 mmol/l). - La dose totale recommandée par semaine est comprise entre 75 et 300 UI/kg.
- Les données cliniques disponibles indiquent que les patients dont le taux d’hémoglobine de départ est très bas (< 6 g/dl ou 3,75 mmol/l) peuvent avoir besoin de doses d’entretien plus importantes que ceux dont l’anémie initiale est moins sévère (> 8 g/dl ou 5 mmol/l).
- Phase correctrice :
- Enfant en hémodialyse :
- Le traitement est divisé en deux phases :
- Phase correctrice :
50 UI/kg 3 fois par semaine par voie intraveineuse. Si un ajustement des doses est nécessaire, il est recommandé de procéder par paliers de 25 UI/kg 3 fois par semaine en respectant un intervalle d’au moins 4 semaines entre chaque ajustement, jusqu’à atteindre le but désiré. - Phase d’entretien :
La posologie est ajustée pour maintenir l’hémoglobine au taux désiré : Hb entre 9,5 et 11 g/dl (5,9 à 6,8 mmol/l). - Généralement, les enfants de moins de 30 kg nécessitent des doses d’entretien plus importantes que ceux de plus de 30 kg et que les adultes. A titre d’exemple, les doses d’entretien suivantes ont été utilisées dans les essais cliniques, après 6 mois de traitement :
Les données cliniques disponibles suggèrent que les patients dont le taux d’hémoglobine initial est très bas (inférieur à 6,8 g/dl ou 4,25 mmol/l) peuvent avoir besoin de doses d’entretien plus importantes que ceux dont l’hémoglobine initiale est plus élevée (supérieure à 6,8 g/dl ou 4,25 mmol/l).Dose (UI/kg 3 fois par semaine) Poids (kg) Moyenne Dose habituelle d’entretien < 10 100 75-150 10-30 75 60-150 > 30 33 30-100
- Phase correctrice :
- Adulte insuffisant rénal non encore dialysé :
- Lorsque la voie intraveineuse n’est pas encore disponible, Eprex peut être administré par voie sous-cutanée.
- Le traitement est divisé en deux phases :
- Phase correctrice :
La posologie initiale est de 50 UI/kg 3 fois par semaine, suivie si nécessaire d’une augmentation des doses de 25 UI/kg (3 fois par semaine) jusqu’à atteindre le but désiré (par paliers d’au moins 4 semaines). - Phase d’entretien :
La posologie est ajustée pour maintenir l’hémoglobine au taux désiré : Hb entre 10 et 12 g/dl (6,2 à 7,5 mmol/l) : dose d’entretien entre 17 et 33 UI/kg 3 fois par semaine. - La posologie maximale ne devrait pas excéder 200 UI/kg 3 fois par semaine.
- Phase correctrice :
- Adulte en dialyse péritonéale :
- Lorsque la voie intraveineuse n’est pas encore disponible, Eprex peut être administré par voie sous-cutanée.
- Le traitement est divisé en deux phases :
- Phase correctrice :
La posologie initiale est de 50 UI/kg 2 fois par semaine.
- Phase d’entretien :
La posologie est ajustée pour maintenir l’hémoglobine au taux désiré : Hb entre 10 et 12 g/dl (6,2 à 7,5 mmol/l) : dose d’entretien entre 25 et 50 UI/kg 2 fois par semaine en 2 injections identiques.
- Phase correctrice :
- Traitement des patients ayant une anémie induite par la chimiothérapie :
- Eprex doit être administré par voie sous-cutanée aux patients ayant une anémie (c’est-à-dire un taux d’hémoglobine <= 10 g/dl (6,2 mmol/l). Les symptômes et conséquences de l’anémie peuvent varier avec l’âge, le sexe et l’impact global de la maladie ; une évaluation par le médecin de l’état de santé et de l’évolution clinique du patient est nécessaire.
- En raison de la variabilité intra-patient, des valeurs individuelles et occasionnelles du taux d’hémoglobine au-dessus et au-dessous du taux d’hémoglobine désiré peuvent être observées chez un même patient. La variabilité du taux d’hémoglobine doit être prise en compte par l’adaptation de la posologie en tenant compte de l’intervalle cible d’hémoglobine de 10 g/dl (6,2 mmol/l) à 12 g/dl (7,5 mmol/l). Un taux d’hémoglobine prolongé supérieur à 12 g/dl (7,5 mmol/l) doit être évité ; des recommandations sur l’adaptation posologique appropriée lorsque les taux d’hémoglobine dépassent 12 g/dl (7,5 mmol/l) sont décrites ci-dessous.
- L’époétine alfa doit continuer à être administrée pendant un mois après la fin de la chimiothérapie.
- La dose initiale est de 150 UI/kg administrée par voie sous-cutanée 3 fois par semaine. Alternativement, Eprex peut être administré par voie sous-cutanée à la dose initiale de 450 UI/kg 1 fois par semaine. Si l’hémoglobine a augmenté d’au moins 1 g/dl (0,62 mmol/l), ou si les réticulocytes ont augmenté d’au moins 40 000/µl par rapport aux valeurs initiales après 4 semaines de traitement, la dose doit rester à 150 UI/kg 3 fois par semaine ou 450 UI/kg 1 fois par semaine. Si l’augmentation de l’hémoglobine est inférieure à 1 g/dl (inférieure à 0,62 mmol/l) et si les réticulocytes ont augmenté de moins de 40 000/µl par rapport aux valeurs initiales, augmenter la dose à 300 Ul/kg 3 fois par semaine. Si après 4 semaines supplémentaires de traitement à 300 Ul/kg 3 fois par semaine, l’hémoglobine a augmenté d’au moins 1 g/dl (au moins 0,62 mmol/l) ou les réticulocytes ont augmenté d’au moins 40 000/µl, la dose de 300 UI/kg 3 fois par semaine doit être maintenue. Cependant, si l’hémoglobine a augmenté de moins de 1 g/dl (moins de 0,62 mmol/l) et les réticulocytes ont augmenté de moins de 40 000/µl par rapport aux valeurs initiales, la réponse est improbable et le traitement doit être arrêté.
- Le schéma thérapeutique proposé est décrit ci-après.
-
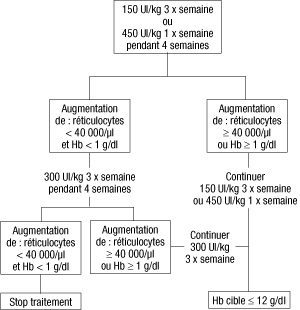
- Les patients doivent être étroitement surveillés afin de s’assurer que la plus faible dose d’agent stimulant l’érythropoïèse (ASE) soit utilisée pour obtenir un contrôle adéquat des symptômes de l’anémie.
-
- Adaptation des doses pour maintenir le taux d’hémoglobine entre 10 et 12 g/dl :
- Si le taux d’hémoglobine augmente de plus de 2 g/dl (1,25 mmol/l) par mois, ou si le taux d’hémoglobine dépasse 12 g/dl (7,5 mmol/l), réduire la dose d’époétine alfa d’environ 25 à 50 %.
- Si le taux d’hémoglobine dépasse 13 g/dl (8,1 mmol/l), interrompre le traitement jusqu’à ce que le taux s’abaisse en dessous de 12 g/dl (7,5 mmol/l) et reprendre le traitement par époétine alfa à une dose de 25 % inférieure à la dose précédente.
- Patient adulte en chirurgie participant à un programme de prélèvement autologue différé :
- La voie intraveineuse doit être utilisée.
- Lors des prélèvements sanguins, l’époétine alfa doit être administrée après la fin du prélèvement de sang.
- La posologie de l’époétine alfa chez les patients ayant une anémie modérée (hématocrite entre 33 et 39 %) qui doivent donner au moins 4 unités de sang est de 600 UI/kg 2 fois par semaine pendant 3 semaines avant l’intervention. En utilisant cette posologie, il a été possible d’obtenir au moins 4 unités de sang chez 81 % des patients traités par l’époétine alfa comparé à 37 % des patients du groupe placebo. L’époétine alfa a réduit les risques d’exposition au sang homologue de 50 % par comparaison aux patients ne recevant pas l’époétine alfa.
- Tous les patients traités par l’époétine alfa doivent recevoir une supplémentation en fer appropriée (par exemple 200 mg par jour de fer-élément per os) pendant toute la durée du traitement par époétine alfa. La supplémentation en fer devra commencer le plus tôt possible, voire même plusieurs semaines avant le début du prélèvement autologue, afin d’atteindre des réserves en fer importantes avant de commencer le traitement par époétine alfa.
- Patient adulte devant bénéficier d’une chirurgie orthopédique majeure programmée :
- La voie sous-cutanée doit être utilisée.
- La dose recommandée est de 600 UI/kg d’époétine alfa, une fois par semaine, pendant les 3 semaines (jours – 21, – 14, – 7) précédant l’intervention chirurgicale et le jour de l’intervention.
- Dans le cas où la période d’intervention doit être réduite pour des raisons médicales à moins de 3 semaines, l’époétine alfa doit être administrée à la dose de 300 UI/kg tous les jours, pendant 10 jours consécutifs avant l’intervention, le jour de l’intervention et pendant les 4 jours suivant l’intervention.
- Lors du bilan biologique préopératoire, si le taux d’hémoglobine atteint 15 g/dl ou plus, l’administration d’époétine alfa doit être arrêtée et les doses ultérieures initialement prévues ne doivent pas être administrées.
- Il faut s’assurer que les patients ne sont pas déficients en fer à l’instauration du traitement.
- Tous les patients traités par l’époétine alfa doivent recevoir une supplémentation en fer appropriée (par exemple 200 mg/jour de fer-élément per os) pendant toute la durée du traitement par époétine alfa. Si possible, la supplémentation en fer devra être commencée avant le traitement par époétine alfa pour constituer des réserves en fer suffisantes.
Mode d’administration :
Comme pour tout produit injectable, vérifier qu’il n’y a ni particules en suspension ni changement de coloration.
- Injection par voie intraveineuse : en 1 à 5 minutes au moins, selon la dose totale. Chez les patients en hémodialyse, une injection en bolus peut être réalisée pendant la séance de dialyse dans le site d’injection approprié situé au niveau du retour veineux de la ligne de dialyse. Une autre possibilité serait de faire l’injection à la suite de la dialyse dans l’aiguille à fistule, en la faisant suivre d’un rinçage par 10 ml de soluté isotonique afin d’assurer le passage correct du produit dans la circulation.
- Une injection plus lente est préférable chez les patients qui auraient présenté des symptômes pseudogrippaux.
- Ne pas administrer en perfusion intraveineuse, ni en mélange avec d’autres médicaments.
- Injection par voie sous-cutanée : on ne doit généralement pas excéder un volume maximal de 1 ml par site d’injection. En cas de volume plus important, utiliser plus d’un site d’injection.
Les injections se font au niveau des membres ou de la paroi abdominale antérieure. - Dans le cas où le médecin décide que le patient ou le personnel soignant peut administrer Eprex par voie sous-cutanée de manière sûre et efficace, des instructions sur le dosage et l’administration doivent être fournies.
- Cf notice : Comment utiliser Eprex (instructions pour l’injection d’Eprex).
CONTRE-INDICATIONS |
- Les patients ayant développé une érythroblastopénie à la suite d’un traitement par une érythropoïétine ne doivent pas être traités par Eprex ou par toute autre érythropoïétine (cf Mises en garde et Précautions d’emploi : Érythroblastopénie).
- Hypertension non contrôlée.
- Toutes les contre-indications associées à un programme de prélèvement autologue différé doivent être respectées chez les patients qui reçoivent l’époétine alfa au cours d’un tel programme.
- Hypersensibilité à la substance active ou à l’un des excipients.
- L’utilisation de l’époétine alfa chez les patients devant bénéficier d’une intervention chirurgicale orthopédique majeure programmée et ne participant pas à un programme de prélèvement autologue différé est contre-indiquée :
- chez les patients présentant une pathologie vasculaire sévère coronarienne, carotidienne, des artères périphériques ou cérébrales, y compris chez les patients présentant des antécédents récents d’infarctus du myocarde ou d’accident vasculaire cérébral ;
- chez les patients qui, quelle qu’en soit la raison, ne peuvent pas recevoir une prophylaxie antithrombotique appropriée.
- chez les patients présentant une pathologie vasculaire sévère coronarienne, carotidienne, des artères périphériques ou cérébrales, y compris chez les patients présentant des antécédents récents d’infarctus du myocarde ou d’accident vasculaire cérébral ;
MISES EN GARDE et PRÉCAUTIONS D’EMPLOI |
- Généralités :
- Chez tous les patients traités par époétine alfa, la tension artérielle doit être suivie étroitement et contrôlée de façon appropriée. L’époétine alfa doit être utilisée avec précaution en présence d’une hypertension non ou insuffisamment traitée ou difficilement contrôlable. Il peut être nécessaire d’instaurer ou d’augmenter le traitement antihypertenseur. Si la pression artérielle ne peut être contrôlée, le traitement par époétine alfa doit être interrompu.
- L’époétine alfa doit également être utilisée avec précaution en présence d’épilepsie ou d’insuffisance hépatique chronique.
- Les taux d’hémoglobine doivent être régulièrement mesurés chez les patients insuffisants rénaux chroniques ou cancéreux jusqu’à ce qu’un taux stable soit atteint, et périodiquement par la suite.
- Chez tous les patients, les taux d’hémoglobine doivent être étroitement surveillés en raison du risque potentiel augmenté d’événements thromboemboliques et d’évolutions fatales lorsque les patients sont traités à des taux d’hémoglobine supérieurs au taux cible de l’indication utilisée.
- Lors d’un traitement par époétine alfa, on peut également observer une augmentation modeste mais dose-dépendante du chiffre des plaquettes, dans les limites de la normale. Celle-ci régresse avec la poursuite du traitement. De plus, des cas de thrombocytémie supérieure au taux normal ont été rapportés. Il est conseillé de surveiller le chiffre des plaquettes à intervalles réguliers pendant les 8 premières semaines de traitement.
- Toutes les autres causes d’anémie (déficit en fer, hémolyse, pertes sanguines, déficit en vitamine B12 ou en folate) doivent être prises en compte et traitées avant d’initier le traitement par époétine alfa. Dans la plupart des cas, les taux de ferritine sérique chutent parallèlement à l’augmentation de l’hématocrite. Afin d’obtenir une réponse optimale au traitement par époétine alfa, il faut s’assurer que les réserves en fer sont suffisantes :
- une supplémentation en fer est recommandée chez les patients insuffisants rénaux chroniques ayant des taux de ferritine sérique inférieurs à 100 ng/ml, sur la base de 200 à 300 mg/jour de fer per os (100 à 200 mg/jour pour l’enfant) ;
- un traitement substitutif en fer de 200 à 300 mg/jour par voie orale est recommandé chez tous les patients cancéreux dont le coefficient de saturation de transferrine est inférieur à 20 %.
- une supplémentation en fer est recommandée chez les patients insuffisants rénaux chroniques ayant des taux de ferritine sérique inférieurs à 100 ng/ml, sur la base de 200 à 300 mg/jour de fer per os (100 à 200 mg/jour pour l’enfant) ;
- Chez les patients cancéreux, l’ensemble de ces autres facteurs d’anémie précités doivent être aussi soigneusement examinés avant de décider d’augmenter la posologie d’époétine alfa.
- L’apparition ou l’aggravation d’une porphyrie a été très rarement observée chez des patients traités par époétine alfa. L’époétine alfa doit être utilisée avec précaution chez les patients atteints de porphyrie.
- Afin d’améliorer la traçabilité des ASE, toutes les mesures nécessaires et possibles pour assurer celle-ci doivent être prises (par exemple l’information exacte concernant le produit utilisé doit être documentée de façon appropriée). De plus, les patients ne peuvent voir leur traitement modifié d’un ASE à un autre que sous une surveillance adaptée.
- Érythroblastopénies :
- Des érythroblastopénies avec anticorps ont été rapportées après plusieurs mois ou années de traitement par époétine par voie sous-cutanée principalement chez des patients en insuffisance rénale chronique. Des cas ont également été rapportés chez des patients atteints d’hépatite C et traités par interféron et ribavirine lors de l’utilisation concomitante d’ASE. Eprex n’est pas approuvé dans la prise en charge de l’anémie associée à une hépatite C.
- Chez les patients présentant une perte soudaine d’efficacité définie par une baisse de l’hémoglobine (de 1 à 2 g/dl par mois), avec augmentation des besoins transfusionnels, une numération des réticulocytes devra être réalisée et les causes habituelles de non réponse (déficit en fer, folates ou vitamine B12, intoxication à l’aluminium, infection ou inflammation, pertes sanguines et hémolyse) devront être recherchées.
- Une diminution paradoxale du taux d’hémoglobine et le développement d’une anémie sévère associée à un faible taux de réticulocytes imposent l’arrêt immédiat du traitement par Eprex et une recherche des anticorps anti-érythropoïétine. Une ponction médullaire devra aussi être envisagée pour confirmer le diagnostic d’érythroblastopénie.
- Aucun traitement par un autre ASE ne devra être débuté en raison du risque de réaction croisée.
- Traitement de l’anémie symptomatique chez l’adulte et l’enfant en insuffisance rénale chronique :
- Chez les patients insuffisants rénaux chroniques, le taux d’hémoglobine doit augmenter d’environ 1 g/dl (0,62 mmol/l) par mois et ne pas dépasser 2 g/dl (1,25 mmol/l) par mois afin de minimiser les risques d’hypertension.
- Chez les patients en insuffisance rénale chronique, le taux d’hémoglobine d’entretien ne doit pas dépasser la limite supérieure du taux d’hémoglobine cible, tel que recommandé en Posologie/Mode d’administration. Dans les études cliniques, un risque augmenté de décès et d’événements cardiovasculaires graves a été observé lorsque les ASE étaient administrés afin d’obtenir un taux d’hémoglobine supérieur à 12 g/dl (7,5 mmol/l).
- Les études cliniques contrôlées n’ont pas montré de bénéfices significatifs attribuables à l’administration d’époétines lorsque le taux d’hémoglobine est augmenté au-delà du taux nécessaire pour contrôler les symptômes de l’anémie et pour éviter une transfusion sanguine.
- Les patients en insuffisance rénale chronique traités par Eprex par voie sous-cutanée devront être suivis régulièrement afin de rechercher une perte d’efficacité, définie par l’absence de réponse ou une diminution de réponse au traitement par Eprex chez des patients antérieurement répondeurs à ce traitement. Cette perte d’efficacité est caractérisée par une diminution constante de l’hémoglobine malgré l’augmentation des doses d’Eprex.
- Des thromboses de la fistule artérioveineuse sont survenues chez les patients hémodialysés, particulièrement chez ceux ayant tendance à l’hypotension ou présentant des complications au niveau de leur fistule (par exemple sténoses, anévrismes, etc.). Une révision précoce de la fistule artérioveineuse et une prophylaxie antithrombotique par administration d’acide acétylsalicylique, par exemple, sont recommandées chez ces patients.
- Une hyperkaliémie a été observée dans des cas isolés, bien que le lien de causalité n’ait pas été établi. L’ionogramme sanguin doit être suivi chez les patients insuffisants rénaux chroniques. En cas d’hyperkaliémie ou d’augmentation de la kaliémie, l’arrêt d’époétine alfa jusqu’à correction du taux sérique de potassium peut être envisagé en plus du traitement approprié de l’hyperkaliémie.
- Lors d’un traitement par époétine alfa, l’augmentation de l’hématocrite rend souvent nécessaire d’augmenter les doses d’héparine pendant l’hémodialyse. La coagulation du système de dialyse peut survenir si l’héparinisation n’est pas optimale.
- D’après les données disponibles à ce jour, la correction de l’anémie par époétine alfa chez les patients insuffisants rénaux non encore dialysés n’accélère pas l’évolution de l’insuffisance rénale.
- Traitement des patients ayant une anémie induite par la chimiothérapie :
- Les érythropoïétines sont des facteurs de croissance qui stimulent essentiellement la production de globules rouges. Des récepteurs à l’érythropoïétine peuvent être présents à la surface de diverses cellules malignes. Comme pour tout facteur de croissance, la possibilité que les érythropoïétines puissent stimuler la croissance de tumeur ne peut pas être exclue. Dans plusieurs études contrôlées, les époétines n’ont pas montré d’amélioration de la survie globale ou de diminution du risque de progression tumorale chez les patients présentant une anémie associée à un cancer.
- Dans des études cliniques contrôlées, l’utilisation d’Eprex ou d’autres ASE a montré :
- une diminution du contrôle locorégional chez des patients atteints d’un cancer de la tête et du cou avancé recevant une radiothérapie lorsque l’administration visait un taux d’hémoglobine supérieur à 14 g/dl (8,7 mmol/l) ;
- un raccourcissement de la survie globale et une augmentation du nombre de décès attribués à la progression de la maladie à 4 mois chez des patients atteints d’un cancer du sein métastatique recevant une chimiothérapie lorsque l’administration visait un taux d’hémoglobine de 12 à 14 g/dl (7,5 à 8,7 mmol/l) ;
- une augmentation du risque de décès lorsque l’administration visait un taux d’hémoglobine de 12 g/dl (7,5 mmol/l) chez des patients ayant une maladie maligne active ne recevant ni chimiothérapie, ni radiothérapie. Les ASE ne sont pas indiqués pour une utilisation dans cette population de patients.
- une diminution du contrôle locorégional chez des patients atteints d’un cancer de la tête et du cou avancé recevant une radiothérapie lorsque l’administration visait un taux d’hémoglobine supérieur à 14 g/dl (8,7 mmol/l) ;
- Au vu des informations ci-dessus, dans certaines situations cliniques, la transfusion sanguine devrait être le traitement privilégié de l’anémie des patients atteints de cancer. La décision d’administrer une érythropoïétine recombinante doit être déterminée sur une évaluation du bénéfice/risque prenant en compte l’avis du patient dans son contexte clinique spécifique. Les facteurs à considérer dans cette évaluation doivent inclure le type de tumeur et son stade, le degré de l’anémie, l’espérance de vie, l’environnement dans lequel le patient est traité et la préférence du patient (cf Pharmacodynamie).
- Lorsque l’on évalue le caractère approprié d’un traitement par époétine alfa chez les patients cancéreux recevant une chimiothérapie (patient à risque d’être transfusé), il faut tenir compte du fait que l’apparition des globules rouges suit l’administration de l’ASE avec un délai de 2 à 3 semaines.
- Une augmentation de l’incidence des événements vasculaires thrombotiques (EVT) ayant été observée chez les patients cancéreux recevant des ASE (cf Effets indésirables), ce risque doit être soigneusement évalué au regard du bénéfice de ce traitement (avec l’époétine alfa), particulièrement chez les patients cancéreux ayant un risque augmenté d’événements vasculaires thrombotiques, comme l’obésité, et les patients ayant des antécédents d’EVT (par exemple thrombose veineuse profonde ou embolie pulmonaire). Une étude clinique (étude BEST) chez des patientes ayant un cancer du sein métastatique a été réalisée afin de déterminer si le traitement par époétine alfa au-delà de la correction de l’anémie pouvait améliorer les résultats thérapeutiques. Dans cette étude, l’incidence d’événements thromboemboliques fatals a été plus élevée chez les patients recevant l’époétine alfa que chez les patients recevant un placebo.
- Patients adultes en chirurgie participant à un programme de prélèvement autologue différé :
- Toutes les mises en garde et précautions particulières d’emploi associées à un programme de prélèvement autologue différé doivent être respectées chez les patients recevant l’époétine alfa, en particulier le remplacement en routine du volume prélevé.
- Patients adultes devant bénéficier d’une chirurgie orthopédique majeure programmée :
- Chez les patients devant bénéficier d’une intervention chirurgicale orthopédique majeure programmée, la cause de l’anémie doit être établie et traitée, si possible, avant l’instauration du traitement par époétine alfa.
- Les événements thromboemboliques peuvent être un risque éventuel dans cette population et cette éventualité doit être soigneusement évaluée en fonction du bénéfice du traitement attendu chez ces patients.
- Les patients devant bénéficier d’une chirurgie orthopédique majeure programmée doivent recevoir une prophylaxie antithrombotique appropriée, dans la mesure où des événements thromboemboliques peuvent survenir chez ces patients, particulièrement chez ceux ayant une pathologie cardiovasculaire sous-jacente.
- De plus, des précautions particulières doivent être prises chez les patients qui ont un risque de développer des thromboses veineuses profondes.
- Enfin, chez les patients ayant un taux initial d’hémoglobine supérieur à 13 g/dl, la possibilité que le traitement par époétine alfa soit associé à un risque accru d’événements thromboemboliques postopératoires ne peut être exclue. En conséquence, l’époétine alfa ne doit pas être utilisée chez les patients qui ont un taux d’hémoglobine initial supérieur à 13 g/dl.
- Teneur en sodium :
- Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose, c’est-à-dire qu’il est essentiellement sans sodium.
INTERACTIONS |
Il n’existe aucune donnée qui indique une éventuelle interaction de l’époétine alfa avec le métabolisme d’autres médicaments. Cependant, étant donné que la ciclosporine se lie aux hématies, une interaction demeure possible. Si l’époétine alfa est administrée en association avec la ciclosporine, les taux sanguins de ciclosporine doivent être surveillés et la dose de ciclosporine ajustée en fonction de l’augmentation de l’hématocrite.
FERTILITÉ/GROSSESSE/ALLAITEMENT |
- chez l’insuffisant rénal chronique, l’époétine alfa ne doit être utilisée en cas de grossesse que si le bénéfice escompté justifie le risque potentiel pour le foetus ;
- l’utilisation de l’époétine alfa n’est pas recommandée chez les patientes enceintes ou allaitant, participant à un programme de prélèvement autologue différé avant chirurgie.
EFFETS INDÉSIRABLES |
- Généralités :
- Chez les patients atteints de cancer et les patients en insuffisance rénale chronique, l’effet indésirable le plus fréquent lors du traitement par époétine alfa est une augmentation dose-dépendante de la pression artérielle ou l’aggravation d’une hypertension préexistante. Une surveillance de la pression artérielle doit être réalisée en particulier en début de traitement (cf Mises en garde et Précautions d’emploi).
- Les autres effets indésirables fréquents, observés lors des études cliniques, sont : thrombose veineuse profonde, embolie pulmonaire, crise convulsive, diarrhée, nausée, céphalée, symptômes grippaux, pyrexie, éruption et vomissement. Des symptômes grippaux tels que céphalées, douleurs articulaires, myalgie et pyrexie peuvent survenir, en particulier en début de traitement. Les fréquences peuvent varier selon l’indication (cf tableau ci-dessous).
- Les effets indésirables graves incluent les thromboses veineuses ou artérielles et les embolies (dont certaines avec issue fatale), telles que thrombose veineuse profonde, embolie pulmonaire, thrombose artérielle (incluant infarctus du myocarde et ischémie myocardique), thrombose rétinienne, thrombose d’une dérivation artérioveineuse (dont la fistule du dialysé). De plus, des accidents cérébrovasculaires (incluant infarctus cérébral et hémorragie cérébrale) et des accidents ischémiques transitoires ont été rapportés lors des études cliniques avec l’époétine alfa.
- Des cas d’anévrisme ont été rapportés.
- Des réactions d’hypersensibilité, incluant éruption, urticaire, réaction anaphylactique et oedème angioneurotique ont été rapportées.
- Des crises hypertensives avec encéphalopathie et crise convulsive, nécessitant l’attention immédiate d’un médecin et la prise en charge en soins intensifs, sont également survenues chez des patients dont la tension était préalablement normale ou basse. Une attention particulière devra être accordée aux céphalées à type de migraines violentes et à début brutal comme un possible signal d’alarme.
- Des érythroblastopénies avec anticorps anti-érythropoïétine ont été rapportées dans de très rares cas (< 1/10 000) après plusieurs mois ou années de traitement par Eprex (cf Mises en garde et Précautions d’emploi).
- Le profil de sécurité d’Eprex a été évalué chez 142 sujets ayant une insuffisance rénale chronique et chez 765 sujets atteints de cancer qui ont participé aux études cliniques d’enregistrement en double aveugle versus placebo.
- Les effets indésirables rapportés par plus de 0,2 % des patients traités par Eprex, dans ces études cliniques, lors d’autres études cliniques et de l’expérience post-commercialisation, sont listés ci-dessous par systèmes d’organes et par fréquence.
- Les fréquences sont définies de la manière suivante : très fréquent (>= 1/10), fréquent (>= 1/100, < 1/10), peu fréquent (>= 1/1000, < 1/100), rare (>= 1/10 000, < 1/1000) ; très rare (< 1/10 000). Une fréquence est définie comme inconnue si l’effet indésirable n’a pas été reporté dans une étude d’enregistrement en double aveugle versus placebo ou lorsque la fréquence n’a pas pu être estimée à partir d’autres données disponibles.
- Dans chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
-
Classes de systèmes d’organes Fréquence Effet indésirable Affections hématologiques et du système lymphatique Peu fréquent Thrombocythémie (patients cancéreux) Fréquence inconnue Érythroblastopénie induite par un anticorps anti-érythropoïétine*
Thrombocythémie (patients en insuffisance rénale chronique)Affection du système immunitaire Fréquence inconnue Réaction anaphylactique
HypersensibilitéAffections du système nerveux Très fréquent Céphalée (patients cancéreux) Fréquent Crise convulsive (patients en insuffisance rénale chronique)
Céphalée (patients en insuffisance rénale chronique)Peu fréquent Hémorragie cérébrale**
Crise convulsive (patients cancéreux)Fréquence inconnue Accident cérébrovasculaire**
Encéphalopathie hypertensive
Accident ischémique transitoireAffections oculaires Fréquence inconnue Thrombose rétinienne Affections vasculaires Fréquent Thrombose veineuse profonde** (patients cancéreux)
HypertensionFréquence inconnue Thrombose veineuse profonde** (patients en insuffisance rénale chronique)
Thrombose artérielle
Crise hypertensiveAffections respiratoires, thoraciques et médiastinales Fréquent Embolie pulmonaire** (patients cancéreux) Fréquence inconnue Embolie pulmonaire** (patient en insuffisance rénale chronique) Affections gastro-intestinales Très fréquent Nausée Fréquent Diarrhée (patients cancéreux)
VomissementPeu fréquent Diarrhée (patient en insuffisance rénale chronique) Affections de la peau et du tissu sous-cutané Fréquent Éruption Fréquence inconnue OEdème angioneurotique
UrticaireAffections musculosquelettiques, des tissus conjonctifs et des os Très fréquent Arthralgie (patient en insuffisance rénale chronique) Fréquent Arthralgie (patients cancéreux) Peu fréquent Myalgie (patients cancéreux) Fréquence inconnue Myalgie (patient en insuffisance rénale chronique) Affections congénitales, familiales et génétiques Fréquence inconnue Porphyrie Troubles généraux et anomalies au site d’administration Très fréquent Pyrexie (patients cancéreux)
Symptômes pseudogrippaux (patient en insuffisance rénale chronique)Fréquent Symptômes pseudogrippaux (patients cancéreux) Fréquence inconnue Traitement inefficace
OEdème périphérique
Pyrexie (patient en insuffisance rénale chronique)
Réaction au site d’injectionInvestigations Fréquence inconnue Anticorps anti-érythropoïétine positif* Lésions, intoxications et complications liées aux procédures Fréquent Thrombose d’une dérivation artérioveineuse incluant la fistule de dialyse (patient en insuffisance rénale chronique) -
*
La fréquence ne peut pas être estimée dans les essais cliniques
-
**
Incluant des cas d’issue fatale
- Patients en insuffisance rénale chronique :
- Chez les patients en insuffisance rénale chronique, un taux d’hémoglobine supérieur à 12 g/dl peut être associé à un risque plus élevé d’événements cardiovasculaires, incluant le décès (cf Mises en garde et Précautions d’emploi).
- Des thromboses de la fistule artérioveineuse sont survenues chez les patients hémodialysés, en particulier chez ceux ayant tendance à l’hypotension ou présentant des complications au niveau de leur fistule (par exemple sténoses, anévrismes, etc.), cf Mises en garde et Précautions d’emploi.
- Patients atteints de cancer :
- Une augmentation de l’incidence des événements thromboemboliques a été rapportée chez des patients atteints de cancer recevant des ASE, incluant l’époétine alfa (cf Mises en garde et Précautions d’emploi).
- Patients devant bénéficier d’une chirurgie :
- Chez les patients devant bénéficier d’une chirurgie orthopédique majeure programmée et ayant un taux initial d’hémoglobine de 10 à 13 g/dl, l’incidence des événements thromboemboliques (dont la plupart étaient des thromboses veineuses profondes), dans l’ensemble des essais cliniques, s’est avérée être similaire dans les différents groupes traités par l’époétine alfa et dans le groupe placebo. Néanmoins, l’expérience clinique est limitée.
- De plus, chez les patients ayant un taux initial d’hémoglobine supérieur à 13 g/dl, la possibilité que le traitement par époétine alfa soit associé à un risque accru d’événements thromboemboliques postopératoires ne peut être exclue.
SURDOSAGE |
PHARMACODYNAMIE |
Autres anti-anémiques/érythropoïétine (classification ATC : B03XA01 ; B : sang et organes hématopoïétiques).
L’érythropoïétine est une glycoprotéine qui stimule la formation d’hématies à partir des cellules souches de la moelle osseuse ; elle agit à ce niveau en tant qu’hormone de différenciation et facteur stimulant les mitoses.
Le poids moléculaire apparent de l’érythropoïétine se situe entre 32 000 et 40 000 daltons. La fraction protéique représente environ 58 % de la molécule et est constituée de 165 acides aminés. Les quatre chaînes glucidiques sont attachées à la protéine par trois liaisons N-glycosidiques et une liaison O-glycosidique. L’époétine alfa obtenue par génie génétique est glycosylée. Sa composition en aminoacides et hydrates de carbone est identique à l’érythropoïétine endogène humaine isolée des urines de patients anémiques.
L’époétine alfa est hautement purifiée selon les méthodes de pointe actuelles. En particulier, aux concentrations de principe actif utilisées chez l’homme, on ne peut détecter aucun résidu de la lignée cellulaire utilisée dans sa production.
L’efficacité biologique de l’époétine alfa a été démontrée grâce aux différents modèles in vivo chez l’animal (rats normaux et anémiques, souris ayant une polyglobulie). Après administration d’époétine alfa, la numération érythrocytaire, le taux d’hémoglobine et le chiffre des réticulocytes augmentent, de même que le taux d’incorporation de 59Fe.
Après incubation de cellules nucléées érythroïdes spléniques in vitro avec l’époétine alfa (culture cellulaire de cellules spléniques de souris), il a été observé une augmentation de l’incorporation de 3H-thymidine.
Grâce à des cellules de moelle osseuse humaine en culture, il a pu être démontré que l’époétine alfa stimule spécifiquement l’érythropoïèse sans avoir d’effets sur la leucopoïèse. Aucune action cytotoxique d’époétine alfa sur les cellules de moelle osseuse humaine n’a été détectée.
721 patients cancéreux recevant une chimiothérapie sans platine ont été inclus dans 3 études contrôlées versus placebo. 389 patients présentaient des hémopathies malignes (221 myélomes multiples, 144 lymphomes non hodgkiniens et 24 autres hémopathies malignes) et 332 patients présentaient des tumeurs solides (172 cancers du sein, 64 cancers gynécologiques, 23 cancers du poumon, 22 cancers de la prostate, 21 cancers gastro-intestinaux et 30 autres types de cancer). Dans 2 larges études en ouvert, 2697 patients cancéreux recevant une chimiothérapie sans platine ont été inclus, 1895 patients présentaient des tumeurs solides (683 cancers du sein, 260 cancers du poumon, 174 cancers gynécologiques, 300 cancers gastro-intestinaux et 478 autres types de cancer) et 802 présentaient des hémopathies malignes.
Dans une étude prospective, randomisée, en double aveugle, contrôlée versus placebo, conduite chez 375 patients anémiés recevant une chimiothérapie sans platine pour diverses hémopathies malignes de type non myéloïde, il a été observé une diminution significative des conséquences de l’anémie (par exemple : fatigue, baisse d’énergie et réduction de l’activité) mesurées par les instruments et échelles suivantes : échelle générale d’évaluation fonctionnelle du traitement de l’anémie du cancer FACT-an, échelle de fatigue FACT-an, et échelle analogue linéaire du cancer (CLAS). Deux autres études, randomisées, contrôlées versus placebo, d’effectifs plus réduits, n’ont pas permis de montrer une amélioration significative des paramètres de qualité de vie sur les échelles EORTC-QLQ-C30 et CLAS respectivement.
L’érythropoïétine est un facteur de croissance qui stimule essentiellement la production de globules rouges. Des récepteurs à l’érythropoïétine peuvent être présents à la surface de diverses cellules malignes.
La survie et la progression tumorale ont été étudiées dans cinq larges études contrôlées incluant un total de 2833 patients dont quatre étaient des études contrôlées contre placebo en double aveugle et une était une étude ouverte. Les études ont soit recruté des patients qui étaient traités par chimiothérapie (deux études), soit utilisé des populations de patients chez lesquelles les ASE n’étaient pas indiqués : anémie chez des patients cancéreux ne recevant pas de chimiothérapie, et patients avec cancers de la tête et du cou recevant une radiothérapie. Le taux d’hémoglobine cible dans deux études était > 13 g/dl ; dans les trois autres études, il était compris entre 12 et 14 g/dl. Dans l’étude ouverte, il n’y a pas eu de différence de la survie globale entre les patients traités par érythropoïétine recombinante humaine et les groupes contrôles. Dans les quatre études contrôlées contre placebo, les rapports de risques pour la survie globale ont été compris entre 1,25 et 2,47 en faveur des groupes contrôles. Ces études ont montré de façon cohérente un excès de mortalité inexpliqué, statistiquement significatif, chez les patients qui avaient une anémie associée à différents types de cancers fréquents qui recevaient une érythropoïétine recombinante humaine par comparaison aux groupes contrôles. Les résultats de survie globale dans les études ne pouvaient pas être expliqués de façon satisfaisante par les différences d’incidence de thromboses et complications associées entre ceux recevant une érythropoïétine recombinante humaine et ceux du groupe contrôle.
Une analyse des données individuelles a également été réalisée sur plus de 13 900 patients cancéreux (traités par chimio, radio, radio et chimiothérapie ou non traités) participant à 53 études contrôlées conduites avec plusieurs époétines. La méta-analyse des données de survie globale a montré un risque relatif estimé à 1,06 en faveur du groupe contrôle (IC 95 % : 1,00, 1,12 ; 53 études et 13 933 patients) et pour les patients cancéreux traités par chimiothérapie, le risque relatif pour la survie globale a été de 1,04 (IC 95 % : 0,97, 1,11 ; 38 études et 10 441 patients). Les méta-analyses ont également montré une augmentation significative constante du risque relatif d’évènements thromboemboliques chez les patients cancéreux recevant une érythropoïétine recombinante humaine (cf Mises en garde et Précautions d’emploi).
PHARMACOCINÉTIQUE |
- Voie intraveineuse :
- Le dosage d’époétine alfa par administration intraveineuse répétée a montré une demi-vie de 4 heures environ chez le volontaire sain et légèrement plus longue chez l’insuffisant rénal, environ 5 heures. Chez l’enfant, la demi-vie est d’environ 6 heures.
- Voie sous-cutanée :
- Après injection sous-cutanée, les taux sériques d’époétine alfa sont largement inférieurs aux taux obtenus après injection intraveineuse ; les taux augmentent lentement pour atteindre leur valeur maximale entre 12 et 18 heures après administration. Le pic est toujours très inférieur au pic obtenu par voie intraveineuse (environ 1/20).
- Il n’y a pas d’accumulation du produit : les taux demeurent identiques, qu’ils soient mesurés 24 heures après la première injection ou 24 heures après la dernière injection.
- La demi-vie est difficile à évaluer pour la voie sous-cutanée, mais elle est estimée à environ 24 heures.
- La biodisponibilité de l’époétine alfa injectable par voie sous-cutanée est très inférieure à celle du produit par voie veineuse : environ 20 %.
SÉCURITE PRÉCLINIQUE |
Lors de certaines études précliniques de toxicologie chez le chien et le rat, mais pas chez le singe, le traitement par époétine alfa a été associé à une fibrose infraclinique de la moelle osseuse.
(La fibrose de la moelle osseuse est une complication connue de l’insuffisance rénale chronique chez l’homme et serait liée à une hyperparathyroïdie secondaire ou à des facteurs encore inconnus. La fréquence de la fibrose médullaire n’a pas été augmentée lors d’une étude chez des patients sous hémodialyse traités par l’époétine alfa pendant 3 ans, par rapport à un groupe témoin apparié de patients sous dialyse qui n’ont pas été traités par l’époétine alfa.)
Chez l’animal, il a été démontré que l’époétine alfa, à une dose hebdomadaire d’environ 20 fois supérieure à la dose hebdomadaire conseillée chez l’homme, diminuait le poids foetal, retardait l’ossification et augmentait la mortalité foetale. Ces modifications seraient secondaires à la diminution de la prise de poids chez la mère.
L’époétine alfa n’a pas montré de modification des tests de mutagénicité des cultures de cellules de bactérie et de mammifère et in vivo dans le test du micronucleus chez la souris.
Des études de carcinogénicité à long terme n’ont pas été réalisées.
Il existe des rapports contradictoires dans la littérature en ce qui concerne le rôle potentiel des érythropoïétines comme proliférateur de tumeur. Ces rapports sont basés sur des conclusions in vitro d’échantillons de tumeur humaine, mais sont d’une signification incertaine en clinique.
INCOMPATIBILITÉS |
En l’absence d’étude de compatibilité ce médicament ne doit pas être mélangé avec d’autres médicaments.
MODALITÉS DE CONSERVATION |
- Durée de conservation :
- 18 mois.
A conserver au réfrigérateur (entre 2 °C et 8 °C). Ces limites de température doivent être strictement respectées jusqu’à l’administration au patient.
A conserver dans l’emballage d’origine, à l’abri de la lumière. Ne pas congeler. Ne pas agiter.
Pour l’usage ambulatoire, le patient peut sortir Eprex du réfrigérateur et le conserver à une température ne dépassant pas 25 °C pour une seule période de 3 jours maximum.
MODALITÉS MANIPULATION/ÉLIMINATION |
Ne pas administrer par perfusion intraveineuse ni en mélange avec d’autres produits en solution.
Avant utilisation, laisser reposer la seringue d’Eprex jusqu’à ce qu’elle atteigne la température ambiante. Ceci prend habituellement 15 à 30 minutes.
Ce produit ne doit pas être utilisé, et doit être éliminé :- si le scellage est endommagé ;
- si le liquide est coloré ou si l’on peut voir des particules en suspension ;
- si l’on sait ou pense que le produit a été accidentellement congelé ;
- s’il y a eu une panne du réfrigérateur.
Ce produit est à usage unique seulement. Utiliser une seule dose d’Eprex de chaque seringue en éliminant la quantité de solution non désirée avant l’injection. Cf notice : Comment utiliser Eprex (instructions pour l’injection d’Eprex).
Les seringues préremplies sont équipées d’un dispositif de sécurité de l’aiguille afin d’éviter les piqûres accidentelles après injection. La notice contient les instructions complètes d’utilisation et de manipulation des seringues préremplies.
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| Prescription initiale hospitalière d’une durée de 1 an. | |
| La prescription initiale par un médecin exerçant dans un service de dialyse à domicile est également autorisée. | |
| AMM | 3400936466654 (2004) 1000 UI/0,5 ml ser. |
| 3400936466715 (2004) 2000 UI/0,5 ml ser. | |
| 3400936466883 (2004) 3000 UI/0,3 ml ser. | |
| 3400936466944 (2004) 4000 UI/0,4 ml ser. | |
| 3400935497031 (2001) 5000 UI/0,5 ml ser. | |
| 3400935497260 (2001) 6000 UI/0,6 ml ser. | |
| 3400935497499 (2001) 8000 UI/0,8 ml ser. | |
| 3400934931215 (1994) 10 000 UI/1 ml ser. | |
| RCP révisés le 30.07.2010. | |
| Prix : | 56.02 euros (1000 UI/0,5 ml, seringue). |
| 106.85 euros (2000 UI/0,5 ml, seringue). | |
| 157.66 euros (3000 UI/0,3 ml, seringue). | |
| 206.69 euros (4000 UI/0,4 ml, seringue). | |
| 254.01 euros (5000 UI/0,5 ml, seringue). | |
| 301.30 euros (6000 UI/0,6 ml, seringue). | |
| 395.92 euros (8000 UI/0,8 ml, seringue). | |
| 489.94 euros (10 000 UI/1 ml, seringue). | |
|
Remb Séc soc à 65 % selon la procédure des médicaments d’exception (prescription en conformité avec la fiche d’information thérapeutique). Collect. |
|
| Prix ou tarif de responsabilité (HT) par UCD : | UCD 9273403 (seringue à 1000 UI/0,5 ml) : 7.371 euros. |
| UCD 9272674 (seringue à 2000 UI/0,5 ml) : 14.740 euros. | |
| UCD 9272645 (seringue à 3000 UI/0,3 ml) : 22.110 euros. | |
| UCD 9272651 (seringue à 4000 UI/0,4 ml) : 29.480 euros. | |
| UCD 9226303 (seringue à 5000 UI/0,5 ml) : 36.860 euros. | |
| UCD 9226326 (seringue à 6000 UI/0,6 ml) : 44.230 euros. | |
| UCD 9226349 (seringue à 8000 UI/0,8 ml) : 58.970 euros. | |
| UCD 9167440 (seringue à 10 000 UI/1 ml) : 73.710 euros. | |
| Inscrit sur la liste des spécialités prises en charge en sus des GHS. | |
JANSSEN-CILAG
1, rue Camille-Desmoulins. TSA 91003
92787 Issy-les-Moulineaux cdx 9
Info médic et Pharmacovigilance :
Tél (n° Vert) : 08 00 14 00 00 E-mail : medisource@its.jnj.com
Liste Des Sections Les Plus Importantes :
- pathologies
- Medicaments
- Medicaments injectables
- Traitement D’Urgence
- Guide Infirmier Des Examens De Laboratoire
- Infirmiers En Urgences
- Fiche Technique Medical
- Techniques De Manipulations En Radiologie Medicale
- Bibliotheque_medicale



