insuline lispro
FORMES et PRÉSENTATIONS |
Humalog® :
Solution injectable à 100 UI/ml (aqueuse stérile, limpide, incolore) :
Flacon de 10 ml, à utiliser avec une seringue appropriée (graduée à 100 unités), boîte unitaire.Cartouches de 3 ml, à utiliser avec un stylo injecteur marqué CE, boîte de 5. Humalog® KwikPenTM :
Solution injectable à 100 UI/ml (aqueuse stérile, limpide, incolore) : Stylos injecteurs préremplis jetables de 3 ml, boîte de 5.
Humalog® Mix25TM :
Suspension injectable à 100 UI/ml (stérile, blanche) : Cartouches de 3 ml, à utiliser avec un stylo injecteur marqué CE, boîte de 5.
Humalog® Mix25TM KwikPenTM :
Suspension injectable à 100 UI/ml (stérile, blanche) : Stylos injecteurs préremplis jetables de 3 ml, boîte de 5.
Humalog® Mix50TM :
Suspension injectable à 100 UI/ml (stérile, blanche) : Cartouches de 3 ml, à utiliser avec un stylo injecteur marqué CE, boîte de 5.
Humalog® Mix50TM KwikPenTM :
Suspension injectable à 100 UI/ml (stérile, blanche) : Stylos injecteurs préremplis jetables de 3 ml, boîte de 5.
COMPOSITION |
| Humalog et Humalog KwikPen : | |
| Flacon : | p flacon |
| Insuline lispro* (DCI) | 1000 UI |
| Cartouche/Stylo : | p cart/p stylo |
| Insuline lispro* (DCI) | 300 UI |
100 UI/ml d’insuline lispro sont équivalents à 3,5 mg/ml.
| Humalog Mix25 et Humalog Mix25 KwikPen : | |
| p cart/p stylo | |
| Insuline lispro* (DCI) | 300 UI |
| Quantité correspondant à : | |
| Insuline lispro en solution | 75 UI |
| Insuline lispro protamine en suspension | 225 UI |
100 UI/ml d’insuline lispro sont équivalents à 3,5 mg/ml.
Humalog Mix25 contient 25 % d’insuline lispro en solution et 75 % d’insuline lispro protamine en suspension.
| Humalog Mix50 et Humalog Mix50 KwikPen : | |
| p cart/p stylo | |
| Insuline lispro* (DCI) | 300 UI |
| Quantité correspondant à : | |
| Insuline lispro en solution | 150 UI |
| Insuline lispro protamine en suspension | 150 UI |
100 UI/ml d’insuline lispro sont équivalents à 3,5 mg/ml.
Humalog Mix50 contient 50 % d’insuline lispro en solution et 50 % d’insuline lispro protamine en suspension.
* ADN d’origine recombinante, produite par Escherichia coli.
INDICATIONS |
- Humalog :
- Traitement des adultes et enfants atteints de diabète nécessitant un traitement par insuline pour maintenir un équilibre glycémique normal.
- Humalog est également indiqué pour la stabilisation initiale du diabète.
- Humalog Mix :
- Traitement des patients atteints de diabète nécessitant un traitement par insuline pour maintenir un équilibre glycémique normal.
POSOLOGIE ET MODE D’ADMINISTRATION |
- Humalog :
- Les préparations d’Humalog doivent être administrées par injection sous-cutanée ou par pompe externe sous-cutanée (cf infra : Utilisation dans une pompe à injection d’insuline) et peuvent également, bien que ce ne soit pas conseillé, être administrées par injection intramusculaire. Si nécessaire, Humalog peut également être administré par voie intraveineuse, par exemple en vue de contrôler la glycémie en cas d’acidocétose, de maladie aiguë, en période opératoire ou post-opératoire.
- Après administration sous-cutanée, Humalog agit rapidement et possède une durée d’action (2 à 5 heures) plus courte que l’insuline rapide. Cette rapidité d’action permet d’administrer une injection d’Humalog (ou, dans le cas d’une administration sous-cutanée continue, un bolus d’Humalog) très peu de temps avant ou après le repas.
- Le début d’action, plus rapide comparé à l’insuline humaine rapide, est maintenu indépendamment du site d’injection.
- Humalog peut être utilisé en association avec une insuline humaine de plus longue durée d’action ou les sulfamides hypoglycémiants, sur les conseils du médecin.
-
- Utilisation d’Humalog dans une pompe à injection d’insuline :
- Seules certaines pompes à insuline disposant d’un marquage CE peuvent être utilisées avec l’insuline lispro. Avant toute perfusion d’insuline lispro, consulter les instructions du fabricant afin de s’assurer que la pompe peut être utilisée. Lire et suivre les instructions qui accompagnent la pompe. Utiliser le réservoir et le cathéter adaptés à la pompe. Changer le matériel d’injection toutes les 48 heures. Respecter les règles d’asepsie lors de l’utilisation du nécessaire à injection. En cas d’épisode hypoglycémique, la perfusion doit être arrêtée jusqu’à ce que l’épisode soit résolu. Si une hypoglycémie répétée ou importante est constatée, le signaler au médecin et envisager de diminuer ou d’arrêter l’injection d’insuline. Un dysfonctionnement de la pompe ou l’obstruction du matériel d’injection peuvent conduire à une augmentation rapide de la glycémie. Si un arrêt du débit d’insuline est suspecté, suivre les instructions portées dans la notice de la pompe et, si nécessaire, contacter un médecin. En cas d’utilisation avec une pompe à insuline, Humalog ne doit pas être mélangé avec une autre insuline.
-
- Administration de l’insuline par voie intraveineuse :
- L’injection d’insuline par voie intraveineuse doit être réalisée selon les pratiques cliniques courantes liées aux injections intraveineuses, par exemple par le biais d’un bolus ou d’une perfusion. Un contrôle fréquent de la glycémie est nécessaire.
- Les préparations pour perfusion, à une concentration comprise entre 0,1 UI/ml et 1,0 UI/ml d’insuline lispro diluée dans du chlorure de sodium à 0,9 % ou du dextrose à 5 %, restent stables 48 heures à température ambiante. Il est recommandé d’amorcer le système avant de commencer la perfusion au patient.
- Humalog Mix :
- Les préparations doivent être administrées par injection sous-cutanée stricte. En aucun cas, Humalog Mix ne doit être administré par voie intraveineuse.
- La rapidité d’action et le pic d’activité précoce propres à Humalog lui-même sont observés après administration sous-cutanée d’Humalog Mix. Ceci permet d’administrer une injection d’Humalog Mix à un moment proche des repas. La durée d’action de la composante insuline lispro protamine en suspension (basale) dans Humalog Mix est proche de celle d’une insuline basale (isophane).
CONTRE-INDICATIONS |
- Hypoglycémie.
- Hypersensibilité à l’insuline lispro ou à l’un de ses composants.
MISES EN GARDE et PRÉCAUTIONS D’EMPLOI |
- Humalog et Humalog Mix :
- Le transfert d’un patient à un autre type d’insuline ou à une autre marque doit se faire sous strict contrôle médical. Le changement de concentration, de marque (fabricant), de type d’insuline (rapide, isophane, zinc, etc.), d’espèce (animale, humaine, analogue d’insuline humaine), et/ou de méthode de fabrication (ADN recombinant versus insuline d’origine animale) peut nécessiter une modification de posologie.
- Certaines conditions, telles qu’un diabète de longue durée, une insulinothérapie intensifiée, une neuropathie diabétique ou un traitement médicamenteux tel que les bêtabloquants, peuvent rendre les signes précurseurs de l’hypoglycémie différents ou moins prononcés.
- Quelques patients ayant présenté des réactions hypoglycémiques après transfert d’une insuline d’origine animale à une insuline humaine ont signalé que les signes précurseurs de l’hypoglycémie étaient moins prononcés ou différents de ceux ressentis lors de leur traitement insulinique antérieur. L’hypoglycémie non corrigée ou les réactions d’hyperglycémie peuvent entraîner une perte de connaissance, un coma ou la mort.
- L’utilisation de posologies mal adaptées ou l’arrêt du traitement, en particulier chez les diabétiques insulinodépendants, peut entraîner une hyperglycémie et une acidocétose diabétique dont le pronostic peut être fatal.
- Les besoins en insuline peuvent diminuer en présence d’une insuffisance rénale.
- Les besoins en insuline peuvent diminuer chez les patients présentant une insuffisance hépatique, du fait d’une diminution de la capacité de la gluconéogenèse et de la diminution de l’élimination de l’insuline ; cependant, chez les patients ayant une insuffisance hépatique chronique, l’augmentation de l’insulino-résistance peut conduire à une augmentation des besoins en insuline.
- Les besoins en insuline peuvent augmenter au cours d’une maladie ou de perturbations affectives.
- L’adaptation posologique peut être nécessaire si le patient augmente son activité physique ou modifie son régime alimentaire habituel. L’exercice physique pratiqué juste après le repas peut augmenter le risque d’hypoglycémie.
-
- Association avec la pioglitazone :
- Des cas d’insuffisance cardiaque ont été observés lorsque l’insuline était associée à la pioglitazone, en particulier chez des patients ayant des facteurs de risque de développement d’insuffisance cardiaque. Cela devra être pris en compte dans le cas où un traitement associant la pioglitazone et Humalog ou Humalog Mix est envisagé. Dans ce cas, l’apparition de signes et symptômes d’insuffisance cardiaque, d’une prise de poids et d’oedèmes devra être surveillée chez ces patients. La pioglitazone doit être arrêtée en cas d’aggravation des symptômes cardiaques.
- Humalog :
- Pour les insulines d’action rapide, les patients recevant également une insuline basale doivent optimiser les doses des deux insulines pour obtenir un bon contrôle glycémique tout au long de la journée, particulièrement la nuit et à jeun.
- Une conséquence de la pharmacodynamie de l’analogue rapide de l’insuline par rapport à l’insuline humaine rapide est que, si une hypoglycémie survient, elle peut survenir très peu de temps après l’injection.
- Humalog doit être utilisé chez les enfants, de préférence à l’insuline rapide, uniquement lorsque la rapidité d’action d’Humalog peut être bénéfique, par exemple dans le choix du moment de l’injection par rapport aux repas.
-
- Humalog flacon :
- Humalog, de durée d’action plus courte, doit être aspiré dans la seringue en premier, afin d’éviter la contamination du flacon par une insuline de durée d’action plus longue. Le mélange d’insulines à l’avance ou juste avant l’injection ne doit se faire que sur les conseils du médecin. Cependant, des habitudes constantes doivent être suivies.
-
- Humalog cartouche :
- Si le produit habituellement prescrit est un flacon de 40 UI/ml, ne pas prélever d’insuline avec une seringue de 40 UI/ml à partir d’une cartouche de 100 UI/ml.
- Humalog Mix :
- Ne jamais administrer Humalog Mix par voie intraveineuse.
- L’administration d’insuline lispro aux enfants de moins de 12 ans doit être envisagée uniquement dans le cas d’un bénéfice attendu par rapport à l’insuline rapide.
INTERACTIONS |
Les besoins en insuline peuvent être augmentés par les médicaments à effet hyperglycémiant, tels que les contraceptifs oraux, les corticostéroïdes ou les traitements substitutifs par hormones thyroïdiennes, le danazol, les bêta-2 sympathomimétiques (tels que ritodrine, salbutamol, terbutaline).
FERTILITÉ/GROSSESSE/ALLAITEMENT |
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
SURDOSAGE |
PHARMACODYNAMIE |
- Humalog : analogue rapide de l’insuline humaine (code ATC : A10AB04).
- Humalog Mix : suspension prémélangée d’insuline lispro (analogue rapide de l’insuline humaine) et d’insuline lispro protamine en suspension (analogue de l’insuline humaine à action intermédiaire) ; code ATC : A10AD04.
L’activité principale de l’insuline lispro est la régulation du métabolisme glucidique.
De plus, les insulines possèdent plusieurs actions anaboliques et anticataboliques dans différents tissus. Dans le tissu musculaire, ces effets comprennent une augmentation de la synthèse du glycogène, des acides gras, du glycérol, des protéines, et une augmentation de la fixation des acides aminés, ainsi qu’une diminution de la glycogénolyse, de la néoglucogenèse, de la cétogenèse, de la lipolyse, du catabolisme protéique et de l’élimination des acides aminés.
La réponse glucodynamique à l’insuline lispro n’est pas affectée par une altération de la fonction rénale ou hépatique. Les différences pharmacodynamiques entre l’insuline lispro et l’insuline rapide humaine, mesurées durant une épreuve de clamp, sont maintenues pour de larges variations de la fonction rénale.
En terme molaire, l’insuline lispro est aussi efficace que l’insuline humaine rapide mais son action est plus rapide et de plus courte durée.
- Humalog :
- L’insuline lispro possède un délai d’action rapide (environ 15 minutes), permettant ainsi son administration peu de temps avant les repas (dans les 15 minutes précédant le repas), par rapport à l’insuline rapide (administration 30 à 45 minutes avant les repas). L’insuline lispro agit rapidement et possède une durée d’action plus courte (2 à 5 heures) que l’insuline rapide.
- Les études cliniques chez les patients diabétiques de type 1 et de type 2 ont montré une hyperglycémie postprandiale diminuée avec l’insuline lispro comparée à l’insuline humaine rapide.
- Comme pour toutes les préparations d’insuline, l’évolution dans le temps de l’action de l’insuline lispro peut varier d’un sujet à l’autre ou à différents moments chez un même sujet et dépend de la dose, du site d’injection, de la vascularisation, de la température et de l’activité physique.
-
Le schéma suivant montre le profil d’activité type, après injection sous-cutanée. 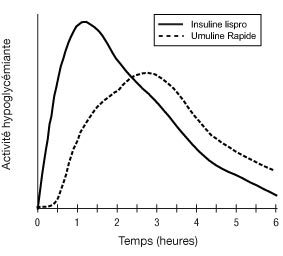
La représentation ci-dessus reflète, en fonction du temps, la quantité relative de glucose nécessaire pour maintenir la glycémie du sujet proche de la valeur à jeun, et est un indicateur de l’effet de ces insulines sur le métabolisme du glucose en fonction du temps.
- Des études cliniques ont été conduites chez les enfants (61 patients âgés de 2 à 11 ans) et chez les enfants et adolescents (481 patients âgés de 9 à 19 ans), comparant l’insuline lispro à l’insuline humaine rapide. Le profil pharmacodynamique de l’insuline lispro chez les enfants est similaire à celui observé chez les adultes.
- Administré par pompe à perfusion sous-cutanée, le traitement par insuline lispro a permis d’obtenir des taux d’hémoglobine glycosylée plus bas, comparé à l’insuline rapide. Dans une étude en double aveugle, cross-over, la réduction des taux d’hémoglobine glycosylée après 12 semaines de traitement était de 0,37 % pour l’insuline lispro et de 0,03 % pour l’insuline rapide (p = 0,004).
- Chez les patients diabétiques de type 2 traités avec des doses maximales de sulfamides hypoglycémiants, les études ont montré que l’association avec l’insuline lispro réduisait significativement les taux d’hémoglobine glycosylée comparativement aux sulfamides hypoglycémiants utilisés seuls. La diminution de l’HbA1c devrait aussi être attendue avec les autres insulines comme, par exemple, l’insuline rapide humaine ou l’insuline isophane.
- Les études cliniques chez les patients diabétiques de type 1 et de type 2 ont montré un nombre réduit d’épisodes d’hypoglycémie nocturne avec l’insuline lispro comparée à l’insuline humaine rapide. Dans quelques études, la réduction de l’hypoglycémie nocturne était aussi associée avec une augmentation du nombre d’épisodes hypoglycémiques durant la journée.
- Humalog Mix :
- L’insuline lispro possède un délai d’action rapide (environ 15 minutes) permettant ainsi son administration peu de temps avant les repas (dans les 15 minutes précédant le repas) par rapport à l’insuline rapide (administration 30 à 45 minutes avant les repas). La rapidité d’action et le pic d’activité précoce de l’insuline lispro sont observés après administration sous-cutanée d’Humalog Mix. Humalog Basal a un profil d’activité très proche de celui d’une insuline basale (isophane) sur une durée de 15 heures environ.
-
Les figures ci-dessous illustrent la pharmacodynamie d’Humalog Mix (25 et 50) et d’Humalog Basal. 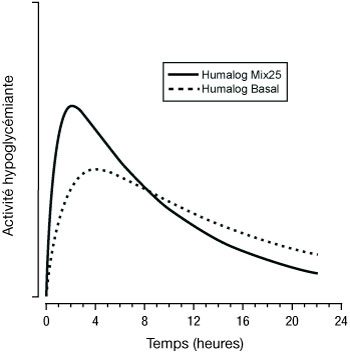
-
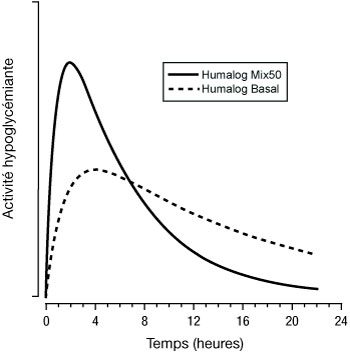
Les représentations ci-dessus reflètent, en fonction du temps, la quantité relative de glucose nécessaire pour maintenir la glycémie du sujet proche de la valeur à jeun, et sont un indicateur de l’effet de ces insulines sur le métabolisme du glucose en fonction du temps.
-
- Humalog Mix25 :
- Les études cliniques chez les patients diabétiques de type 1 et de type 2 ont montré une hyperglycémie postprandiale diminuée avec Humalog Mix25 comparé à l’insuline humaine prémélangée 30/70. Dans une étude clinique, il y a eu une faible augmentation (0,38 mmol/l) de la glycémie durant la nuit (3 heures).
- Dans deux études cliniques d’une durée de 8 mois en ouvert et en crossover, des patients diabétiques de type 2, qui n’avaient jamais été traités par de l’insuline ou qui étaient déjà traités par de l’insuline en 1 ou 2 injections, ont reçu soit un traitement par Humalog Mix25 pendant 4 mois (2 fois par jour en association avec de la metformine) soit un traitement par insuline glargine pendant 4 mois (1 fois par jour en association avec de la metformine) selon une séquence randomisée. Des informations détaillées sont disponibles dans le tableau ci-dessous.
-
Patients n’ayant jamais été traités par de l’insuline
n = 78Patients déjà traités par de l’insuline
n = 97Dose quotidienne moyenne d’insuline à la fin de l’étude 0,63 U/kg 0,42 U/kg Réduction de l’hémoglobine A1c(1) 1,30 %
(moyenne à l’inclusion = 8,7 %)1,00 %
(moyenne à l’inclusion = 8,5 %)Réduction de la moyenne combinant les glycémies postprandiales du matin et du soir(1) 3,46 mM 2,48 mM Réduction de la glycémie à jeun moyenne(1) 0,55 mM 0,65 mM Incidence des hypoglycémies à la fin de l’étude 25 % 25 % Prise de poids(2) 2,33 kg 0,96 kg -
(1)
Entre l’inclusion et la fin du traitement par Humalog Mix25.
-
(2)
Chez les patients randomisés dans le bras Humalog Mix25 pendant la première période de crossover.
PHARMACOCINÉTIQUE |
Pour déterminer la signification clinique de la cinétique, il est plus approprié d’examiner les courbes de l’activité des insulines sur l’utilisation du glucose par l’organisme (cf Pharmacodynamie).
La pharmacocinétique de l’insuline lispro révèle une absorption rapide et un pic sanguin atteint 30 à 70 minutes après l’administration sous-cutanée.
L’insuline lispro conserve une absorption plus rapide, comparée à l’insuline rapide humaine, chez les patients ayant une insuffisance rénale. Chez les patients présentant un diabète de type 2, les différences pharmacocinétiques entre l’insuline lispro et l’insuline rapide humaine sont en général maintenues pour de larges variations de la fonction rénale et se sont révélées être indépendantes de la fonction rénale. L’insuline lispro garde une absorption et une élimination plus rapides, comparées à l’insuline rapide humaine, chez les patients ayant une insuffisance hépatique.
- Insuline lispro protamine (Humalog Mix) :
- La pharmacocinétique d’Humalog Mix est représentative des propriétés pharmacocinétiques de ses deux composantes.
- La pharmacocinétique de l’insuline lispro protamine en suspension concorde avec celle d’une insuline à action intermédiaire telle que l’insuline isophane.
SÉCURITE PRÉCLINIQUE |
Dans les tests in vitro, comprenant la fixation sur les récepteurs de l’insuline et les effets sur les cellules en phase de croissance, l’insuline lispro s’est comportée de façon très semblable à l’insuline humaine.
Des études montrent que la dissociation de la liaison de l’insuline lispro au récepteur à l’insuline est équivalente à celle de l’insuline humaine. Les études de toxicologie aiguë, à 1 mois et à 12 mois, n’ont pas permis de mettre en évidence d’effets toxiques significatifs.
L’insuline lispro n’a pas provoqué d’altération de la fertilité, d’embryotoxicité ou de tératogénicité dans les études réalisées chez l’animal.
INCOMPATIBILITÉS |
- Humalog :
- Les préparations d’Humalog ne doivent pas être mélangées avec des insulines produites par d’autres fabricants ou avec des préparations d’insuline d’origine animale.
- Humalog flacon :
- Ce médicament ne doit pas être mélangé avec d’autres médicaments à l’exception de ceux mentionnés dans la rubrique Modalités de manipulation et d’élimination.
- Humalog Mix :
- Le mélange d’Humalog Mix avec d’autres insulines n’a pas été étudié. En l’absence d’études de compatibilité, ce médicament ne doit pas être mélangé avec d’autres médicaments.
MODALITÉS DE CONSERVATION |
- Durée de conservation :
- 2 ans (flacon) ou 3 ans (cartouches et stylos préremplis).
A conserver au réfrigérateur (entre 2 ° et 8 °C).
Ne pas congeler. Ne pas exposer à une chaleur excessive ou au soleil.
- Après la première utilisation :
- A utiliser dans les 28 jours.
- Flacon : à conserver au réfrigérateur (entre 2 ° et 8 °C) ou à une température ne dépassant pas 30 °C.
- Stylos, cartouches : à conserver à une température ne dépassant pas 30 °C. Ne pas réfrigérer. Le stylo prérempli ou le stylo avec la cartouche à l’intérieur ne doivent pas être conservés avec l’aiguille vissée dessus.
MODALITÉS MANIPULATION/ÉLIMINATION |
Précautions particulières d’élimination :
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Instructions pour l’utilisation et la manipulation :
- Humalog :
- Examiner la solution d’Humalog flacon, cartouche, ou d’Humalog KwikPen. Elle doit être limpide et incolore. Ne pas utiliser la solution d’Humalog flacon, cartouche, ou d’Humalog KwikPen, si elle apparaît trouble, épaissie ou légèrement colorée, ou si elle présente des particules visibles.
- Mélange d’insulines : ne pas mélanger de l’insuline en flacon avec de l’insuline en cartouche (cf Incompatibilités).
- Humalog Mix :
- Examiner les cartouches régulièrement et ne pas les utiliser si la suspension présente des grumeaux visibles ou si des particules blanches restent collées au fond de la cartouche ou sur les parois, lui donnant un aspect givré.
- Flacon (Humalog) :
- Le flacon d’Humalog doit être utilisé avec une seringue appropriée (graduée à 100 unités).
-
- Préparation d’une dose :
-
- Se laver les mains.
- S’il s’agit d’un flacon neuf, retirer la capsule de protection en plastique, mais ne pas retirer le bouchon.
- Si le schéma thérapeutique nécessite l’injection simultanée d’insuline basale et d’Humalog, les deux produits peuvent être mélangés dans la même seringue. S’il s’agit de mélanger deux insulines, se reporter aux instructions pour le mélange ci-dessous et à la rubrique Incompatibilités.
- Aspirer dans la seringue un volume d’air égal à celui de la dose prescrite d’Humalog.
- Essuyer l’extrémité supérieure du flacon avec un coton imbibé d’alcool. Insérer l’aiguille dans le bouchon en caoutchouc du flacon d’Humalog et injecter l’air dans le flacon.
- Retourner le flacon et la seringue. Tenir le flacon et la seringue fermement dans une main.
- En s’assurant que la pointe de l’aiguille se trouve dans la solution d’Humalog, aspirer la dose correcte dans la seringue.
- Avant de retirer l’aiguille du flacon, vérifier que la seringue ne contient pas de bulles d’air qui pourraient réduire la quantité d’Humalog. En cas de présence de bulles, tenir la seringue droite et tapoter sur les côtés jusqu’à ce que les bulles d’air remontent. Les chasser à l’aide du piston et aspirer la dose correcte.
- Retirer l’aiguille du flacon et poser la seringue à plat en s’assurant que rien n’entre en contact avec l’aiguille.
- Se laver les mains.
-
- Préparation d’un mélange d’Humalog et d’une insuline humaine à action plus prolongée (cf Incompatibilités) :
-
- Humalog ne doit être mélangé avec des insulines humaines à action plus prolongée que sur les conseils d’un médecin.
- Aspirer dans la seringue un volume d’air égal au volume à injecter d’insuline à action plus prolongée. Insérer l’aiguille dans le flacon d’insuline à action prolongée et injecter l’air. Retirer l’aiguille.
- Puis injecter de l’air de la même façon dans le flacon d’Humalog, mais ne pas retirer l’aiguille.
- Retourner le flacon et la seringue.
- En s’assurant que la pointe de l’aiguille se trouve dans la solution d’Humalog, aspirer la dose correcte d’Humalog dans la seringue.
- Avant de retirer l’aiguille du flacon, vérifier que la seringue ne contient pas de bulles d’air qui pourraient réduire la quantité d’Humalog. En cas de présence de bulles, tenir la seringue droite et tapoter sur les côtés jusqu’à ce que les bulles d’air remontent. Les chasser à l’aide du piston et aspirer la dose correcte.
- Retirer l’aiguille du flacon d’Humalog et l’insérer dans le flacon d’insuline à action plus prolongée. Retourner le flacon et la seringue. Tenir le flacon et la seringue fermement dans une main et agiter doucement. S’assurer que la pointe de l’aiguille plonge dans la solution d’insuline puis retirer la dose d’insuline à action plus prolongée.
- Retirer l’aiguille du flacon et poser la seringue à plat en s’assurant que rien n’entre en contact avec l’aiguille.
- Humalog ne doit être mélangé avec des insulines humaines à action plus prolongée que sur les conseils d’un médecin.
-
- Injection d’une dose :
-
- Choisir un site d’injection.
- Nettoyer la peau selon les instructions.
- Stabiliser la peau en étirant ou en pinçant une zone de peau assez large. Piquer et injecter selon les instructions.
- Retirer l’aiguille et appliquer une pression doucement sur le point d’injection pendant quelques secondes. Ne pas frotter la peau.
- Jeter la seringue et l’aiguille selon les consignes de sécurité.
- Varier les points d’injection afin que le même point ne soit pas utilisé plus d’une fois par mois environ.
- Choisir un site d’injection.
- Cartouche (Humalog et Humalog Mix) :
- Les cartouches d’Humalog Mix ne sont pas conçues pour la réalisation d’un mélange avec d’autres insulines. Les cartouches vides ne peuvent être réutilisées.
- Les cartouches sont à utiliser avec un stylo injecteur marqué CE, ainsi que recommandé dans la documentation fournie par le fabricant du stylo injecteur.
- La description qui suit est d’ordre général. Les instructions particulières du fabricant pour chaque stylo injecteur doivent être suivies pour charger la cartouche, fixer l’aiguille et pratiquer l’injection d’insuline.
-
- Préparation d’une dose (Humalog Mix) :
- Faire rouler la cartouche 10 fois entre les paumes des mains et la renverser à 180° 10 fois, juste avant son utilisation, afin de remettre l’insuline en suspension, jusqu’à ce qu’elle prenne un aspect uniformément trouble ou laiteux. Si cet aspect n’est pas obtenu, répéter la procédure ci-dessus jusqu’à ce que le contenu de la cartouche soit bien mélangé. Les cartouches contiennent une petite bille de remise en suspension pour faciliter le mélange. Ne pas agiter vigoureusement, car la formation d’une mousse pourrait gêner la mesure exacte de la dose.
-
- Injection d’une dose :
-
- Se laver les mains.
- Choisir un site d’injection.
- Nettoyer la peau selon les instructions.
- Retirer le capuchon de l’aiguille.
- Stabiliser la peau en étirant ou en pinçant une zone de peau assez large. Piquer selon les instructions.
- Appuyer sur le bouton.
- Retirer l’aiguille et appliquer une pression doucement sur le point d’injection pendant quelques secondes. Ne pas frotter la peau.
- A l’aide du capuchon extérieur de l’aiguille, dévisser l’aiguille et la jeter selon les consignes de sécurité.
- Varier les points d’injection afin que le même point ne soit pas utilisé plus d’une fois par mois environ.
- Se laver les mains.
- KwikPen (Humalog et Humalog Mix) :
-
- Préparation d’une dose (Humalog Mix) :
- Faire rouler le stylo 10 fois entre les paumes des mains et le retourner à 180° 10 fois, juste avant son utilisation, afin de remettre l’insuline en suspension, jusqu’à ce qu’elle prenne un aspect uniformément trouble ou laiteux. Si tel n’est pas le cas, répéter la procédure ci-dessus jusqu’à ce que le contenu soit bien mélangé. Les cartouches contiennent une petite bille de remise en suspension pour faciliter le mélange. Ne pas agiter vigoureusement, car la formation d’une mousse pourrait gêner la mesure exacte de la dose.
-
- Manipulation du stylo prérempli :
- Avant d’utiliser le stylo KwikPen, lire attentivement le manuel d’utilisation inclus dans la notice d’information de l’utilisateur. Le stylo KwikPen doit être utilisé selon les recommandations du manuel d’utilisation.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM | EU/1/96/007/002 ; CIP 3400934142680 (RCP rév 17.02.2011) Humalog flacon. |
| EU/1/96/007/004 ; CIP 3400934373930 (RCP rév 17.02.2011) Humalog cartouche. | |
| EU/1/96/007/031 ; CIP 3400938510980 (2008, RCP rév 17.02.2011) Humalog KwikPen. | |
| EU/1/96/007/008 ; CIP 3400934944512 (RCP rév 17.02.2011) Humalog Mix25 cartouche. | |
| EU/1/96/007/033 ; CIP 3400938511062 (2008, RCP rév 17.02.2011) Humalog Mix25 KwikPen. | |
| EU/1/96/007/006 ; CIP 3400934944680 (RCP rév 17.02.2011) Humalog Mix50 cartouche. | |
| EU/1/96/007/035 ; CIP 3400938511123 (2008, RCP rév 17.02.2011) Humalog Mix50 KwikPen. |
| Prix : | 21.65 euros (flacon 10 ml Humalog). |
| 39.74 euros (5 cartouches Humalog). | |
| 43.18 euros (5 stylos Humalog KwikPen). | |
| 41.40 euros (5 cartouches Humalog Mix25). | |
| 43.18 euros(5 stylos Humalog Mix25 KwikPen). | |
| 41.40 euros (5 cartouches Humalog Mix50). | |
| 43.18 euros(5 stylos Humalog Mix50 KwikPen). | |
| Remb Séc soc à 65 %. Collect. | |
Titulaire de l’AMM : Eli Lilly Nederland BV.
LILLY FRANCE SAS
13, rue Pagès. 92158 Suresnes cdx
Standard : Tél : 01 55 49 34 34
Info médic/Pharmacovigilance :
Tél : 01 55 49 32 51 ou N° Vert : 08 00 00 36 36
Fax : 01 55 49 33 07
Logistique produits :
Tél : 01 55 49 33 21. Fax : 01 55 49 34 85
Site web : http://www.lilly.fr
Liste Des Sections Les Plus Importantes :
- pathologies
- Medicaments
- Medicaments injectables
- Traitement D’Urgence
- Guide Infirmier Des Examens De Laboratoire
- Infirmiers En Urgences
- Fiche Technique Medical
- Techniques De Manipulations En Radiologie Medicale
- Bibliotheque_medicale



