chlorure de mivacurium
FORMES et PRÉSENTATIONS |
COMPOSITION |
| p ampoule | ||||
| 10 mg/5 ml | 20 mg/10 ml | |||
| Mivacurium | 10 mg | 20 mg | ||
| (sous forme de mivacurium chlorure [DCI] : 10,7 mg/amp à 10 mg/5 ml ; 21,4 mg/amp à 20 mg/10 ml) | ||||
INDICATIONS |
POSOLOGIE ET MODE D’ADMINISTRATION |
- Adulte :
- Le mivacurium s’administre en bolus de 5 à 15 secondes. La dose initiale recommandée est de 0,07 à 0,15 mg/kg, elle procure une curarisation profonde pendant 10 à 15 minutes et 15 à 20 minutes respectivement.
- Une dose de 0,15 mg/kg de mivacurium procure de bonnes conditions d’intubation trachéale en 2,5 minutes chez la majorité des patients.
- Si des doses supérieures étaient nécessaires pour l’intubation, la durée de curarisation serait fonction de la dose. Pour des doses de 0,20 mg/kg et 0,25 mg/kg, l’injection devra s’effectuer en 30 à 60 secondes du fait de l’histaminolibération et de l’hypotension éventuellement provoquée (cf Effets indésirables).
- La curarisation peut être prolongée par des doses d’entretien de mivacurium. Des doses de 0,1 mg/kg administrées au cours d’une anesthésie aux morphiniques procurent environ 15 minutes de curarisation supplémentaire. Plusieurs doses d’entretien peuvent être successivement administrées sans que l’on observe d’effet curarisant cumulatif. Cependant, le délai entre deux injections doit être ajusté en fonction du monitorage neuromusculaire.
- L’action curarisante du mivacurium est potentialisée par l’isoflurane ou l’enflurane. Lorsque l’anesthésie avec ces produits est stabilisée, il est recommandé de réduire la dose initiale d’environ 25 %. L’halothane semble avoir un effet potentialisateur minime sur le mivacurium et il n’est probablement pas nécessaire de réduire les doses de mivacurium.
- Une fois la décurarisation commencée, celle-ci est en règle générale achevée de façon complète en 15 minutes environ et le délai de décurarisation est indépendant de la dose de mivacurium administrée.
- La décurarisation sera monitorée à l’aide d’un stimulateur de nerf.
- Utilisation en perfusion intraveineuse chez l’adulte :
- Mivacron est compatible avec les liquides de perfusion suivants (concentration à 0,5 mg/ml : dilution au ¼) :
- solution de chlorure de sodium à 0,9 %,
- solution glucosée à 5 %,
- solution glucosée à 5 %, sodique à 0,9 %,
- liquide de Ringer.
- solution de chlorure de sodium à 0,9 %,
- Mivacron, une fois dilué, est stable chimiquement et physiquement pendant au moins 48 heures à la température de 30 °C. Mivacron ne contenant aucun conservateur antimicrobien, il est recommandé de ne pas conserver la solution préparée à l’avance pendant plus de 12 heures.
- La solution de Mivacron est acide et compatible avec le fentanyl, l’alfentanil, le sufentanil, le dropéridol et le midazolam. Ne pas mélanger, dans la même seringue, Mivacron avec du thiopental ou tout autre produit alcalin.
- Après administration du bolus initial, la curarisation peut être prolongée en administrant le mivacurium en perfusion intraveineuse. Dès l’observation des premiers signes de décurarisation, observés grâce au monitorage instrumental, une perfusion peut être débutée avec un débit de 8 à 10 µg/kg/min (0,5 à 0,6 mg/kg/h). Le débit de perfusion doit être ajusté en fonction du monitorage neuromusculaire. Comme les doses nécessaires à l’obtention d’un niveau donné de curarisation sont très variables d’un patient à l’autre, l’utilisation d’un stimulateur périphérique de nerf est recommandée pour éviter au mieux le risque de surdosage ou l’inconvénient d’un sous-dosage. L’ajustement du débit de perfusion doit être fait par paliers d’environ 1 µg/kg/min (0,06 mg/kg/h). En général, un débit de perfusion donné doit être maintenu pendant au moins 3 minutes avant d’en changer. Un débit de perfusion de 6 à 7 µg/kg/min permet un bloc neuromusculaire d’environ 89 à 99 % au cours d’une anesthésie aux morphiniques.
- Au cours d’une anesthésie à l’isoflurane et à l’enflurane, lorsque l’anesthésie est stabilisée, il peut être nécessaire de réduire le débit de perfusion jusqu’à 40 %. Avec l’halothane, les réductions sont plus faibles.
- La réversibilité de la curarisation induite par le mivacurium est indépendante de la durée de la perfusion et les délais de décurarisation sont comparables à ceux observés après administration du produit en bolus.
- Enfant de 7 mois à 12 ans :
- Chez l’enfant, les études de curarisation ont toutes été faites sous anesthésie à l’halothane.
- Chez l’enfant de 7 mois à 12 ans, le mivacurium possède une DE 95 plus élevée (approximativement 0,1 mg/kg), un délai d’action plus rapide, une durée d’action plus courte et une réversibilité plus rapide que chez l’adulte.
- La dose initiale recommandée est de 0,1 à 0,2 mg/kg administrée en 5 à 15 secondes.
- Une dose de 0,2 mg/kg administrée au cours d’une anesthésie stabilisée à l’halothane ou aux morphiniques procure une curarisation pendant environ 9 minutes.
- La dose recommandée pour intuber dans de bonnes conditions est de 0,2 mg/kg. La curarisation est maximale 2 minutes environ après l’administration, c’est-à-dire 0,5 à 1 minute plus vite que chez l’adulte.
- L’administration de doses d’entretien doit se faire plus fréquemment que chez l’adulte. Une dose d’entretien de 0,1 mg/kg procure une curarisation profonde pendant 6 à 9 minutes supplémentaires.
- Le débit de perfusion nécessaire chez l’enfant est généralement plus élevé que chez l’adulte. Au cours d’une anesthésie à l’halothane, le débit de perfusion nécessaire pour maintenir un bloc neuromusculaire entre 89 et 99 %, chez l’enfant âgé de 7 à 23 mois, est en moyenne de 11 µg/kg/min (0,7 mg/kg/h).
- Chez l’enfant âgé de 2 à 12 ans, le débit de perfusion est en moyenne de 13 à 14 µg/kg/min (0,8 mg/kg/h) au cours d’une anesthésie à l’halothane ou aux morphiniques.
- Une fois un début de récupération obtenu, celle-ci est complète en approximativement 10 minutes.
- Nourrisson de 2 à 6 mois :
- Chez le nourrisson, les études de curarisation ont toutes été faites sous anesthésie à l’halothane.
- La DE 95 est identique à celle de l’adulte (0,07 mg/kg).
- Chez le nourrisson de 2 à 6 mois, le mivacurium possède un délai d’action plus rapide, une durée d’action plus courte et une réversibilité plus rapide que chez l’adulte.
- La dose initiale recommandée est de 0,1 à 0,15 mg/kg. Une dose de 0,15 mg/kg administrée au cours d’une anesthésie stable à l’halothane procure une curarisation profonde pendant 9 minutes environ. La dose recommandée pour intuber dans de bonnes conditions est de 0,15 mg/kg. La curarisation est maximale 1,4 minute environ après l’administration.
- L’administration de doses d’entretien doit se faire plus fréquemment que chez l’adulte.
- Une dose d’entretien de 0,1 mg/kg au cours d’une anesthésie à l’halothane procure une curarisation profonde pendant 7 minutes supplémentaires.
- Le débit de perfusion nécessaire chez le nourrisson est généralement plus élevé que chez l’adulte.
- Au cours d’une anesthésie à l’halothane, le débit de perfusion nécessaire pour maintenir un bloc neuromusculaire entre 89 et 99 % est en moyenne de 11 µg/kg/min (de 4 à 24 µg/kg/min), soit 0,7 mg/kg/h. Une fois la décurarisation commencée, elle est complète en 10 minutes environ.
- Sujet âgé :
- Le mivacurium administré en bolus a une durée d’action et un délai de réversibilité plus longs de 20 à 30 % que chez l’adulte, à doses égales. Les sujets âgés peuvent nécessiter un débit de perfusion moindre que chez l’adulte ou encore l’administration de bolus d’entretien plus faibles et moins fréquents.
- Patient ayant une insuffisance rénale :
- Une dose de 0,15 mg/kg de chlorure de mivacurium est recommandée pour faciliter l’intubation trachéale.
- Chez les patients ayant une insuffisance rénale terminale, la durée de curarisation cliniquement efficace induite par cette dose est environ 1,5 fois plus longue que chez les patients à fonction rénale normale avec la même dose.
- En conséquence, la dose administrée doit être ajustée en fonction de la réponse individuelle de chaque patient.
- Un bloc neuromusculaire prolongé et intensifié peut également survenir chez les patients ayant une insuffisance rénale aiguë ou chronique en raison d’un taux réduit de cholinestérases plasmatiques (cf Mises en garde et Précautions d’emploi).
- Patient ayant une insuffisance hépatique :
- Une dose de 0,15 mg/kg de mivacurium est recommandée pour faciliter l’intubation trachéale. Chez les malades ayant une insuffisance hépatique terminale, la durée de curarisation cliniquement efficace induite par cette dose est environ 3 fois plus longue que chez les patients à fonction hépatique normale. Cette prolongation de curarisation est due à une réduction notable de l’activité des cholinestérases plasmatiques (pseudocholinestérases) chez ces patients. En conséquence, la dose administrée doit être ajustée en fonction de la réponse individuelle de chaque patient.
- Sujet présentant une pathologie cardiovasculaire sévère :
- La dose initiale de mivacurium doit être administrée lentement en 60 secondes. L’injection lente de mivacurium chez des sujets subissant un remplacement valvulaire ou un pontage coronarien n’a pas eu d’effets hémodynamiques significatifs.
- Patient ayant une activité cholinestérase plasmatique (pseudocholinestérasique) réduite d’au moins 20 % :
- Le mivacurium est métabolisé par les pseudocholinestérases plasmatiques. L’activité de ces cholinestérases plasmatiques est diminuée chez les patients ayant une anomalie génétique des cholinestérases plasmatiques (patients hétérozygotes ou homozygotes pour un gène atypique des cholinestérases plasmatiques), dans diverses conditions pathologiques (cf Mises en garde et Précautions d’emploi), et lors de l’administration concomitante d’autres médicaments (cf Interactions)
- On peut observer une curarisation prolongée après administration de mivacurium chez les patients avec une activité cholinestérase plasmatique réduite. Des réductions modérées de cette activité (dans les 20 % de la limite basse de la normale) ne sont pas associées à des effets cliniquement significatifs sur la durée de curarisation (cf Contre-indications, Mises en garde et Précautions d’emploi : pour les informations concernant les patients homozygotes et hétérozygotes).
- Patient obèse (pesant 30 % de plus que son poids idéal) :
- La dose initiale de mivacurium doit être calculée en fonction du poids idéal et non du poids réel.
CONTRE-INDICATIONS |
- Absolues :
-
- Hypersensibilité au mivacurium.
- Nouveau-né de moins de 2 mois.
- Patient ayant des antécédents de curarisation prolongée avec un curare métabolisé par les cholinestérases plasmatiques, ou ayant un déficit homozygote connu en cholinestérases plasmatiques.
- Hypersensibilité au mivacurium.
- Relatives :
-
- Toxine botulique.
- Toxine botulique.
MISES EN GARDE et PRÉCAUTIONS D’EMPLOI |
Mises en garde :
Le mivacurium ne doit être administré que par des anesthésistes ou des praticiens familiarisés avec l’utilisation et l’action des curares, ou sous leur contrôle. Du matériel d’intubation trachéale, d’assistance respiratoire et d’oxygénation artérielle adéquat doit être disponible.
Le mivacurium doit être utilisé sous contrôle du niveau de curarisation (aussi bien chez les nourrissons que chez les enfants et les adultes).
Précautions d’emploi :- Des réactions anaphylactiques aux curares en général ont été décrites (parfois sévères, telles que choc, arrêt cardiaque). Bien que ces phénomènes ne se produisent que très rarement avec le mivacurium, des précautions doivent toujours être prises pour pallier la survenue éventuelle de ces réactions (cf Effets indésirables).
- Il convient de prendre des précautions particulières dans les cas d’antécédents connus de réactions anaphylactiques aux curares, car un taux élevé de réactions allergiques croisées (supérieur à 50 %) entre les curares a été rapporté.
- Antagonisme du bloc neuromusculaire :
Comme les doses nécessaires à l’obtention d’un niveau donné de curarisation sont très variables d’un patient à l’autre, l’utilisation d’un stimulateur périphérique de nerf est fortement recommandée, avant et jusqu’à complète réversibilité du bloc neuromusculaire, pour éviter au mieux le risque de surdosage ou l’inconvénient d’un nouveau sous-dosage. - En cas d’apnée prolongée, il faut maintenir la ventilation assistée jusqu’à réapparition spontanée d’une respiration et d’une activité musculaire efficace.
- Le mivacurium est hydrolysé par les pseudocholinestérases ou butyrylcholinestérases, et le seul anticholinestérasique injectable d’action rapide disponible en France est la néostigmine, qui est un inhibiteur partiel des pseudocholinestérases. Au lieu de favoriser l’antagonisation du bloc provoqué par le mivacurium, la néostigmine ralentit le métabolisme et prolonge donc la durée d’action du mivacurium, et produit donc un effet inverse de celui initialement recherché.
- Dans tous les cas, un monitorage précis de la curarisation, et donc de la décurarisation, est indispensable ainsi que le maintien d’une ventilation assistée jusqu’à réapparition spontanée d’une respiration et d’une activité musculaire efficaces.
- Le mivacurium doit être utilisé avec précaution chez les patients souffrant de myasthénie ou d’autres maladies neuromusculaires, d’anomalies électrolytiques (hypokaliémie, hypocalcémie) ou ayant des antécédents familiaux de curarisation prolongée avec un curare métabolisé par les cholinestérases plasmatiques.
- Chez les patients ayant une diminution de l’activité des cholinestérases plasmatiques, il est possible d’observer une prolongation et une intensification du bloc neuromusculaire dans les états suivants ou conditions biologiques ou cliniques pathologiques suivantes :
- en cas de modification physiologique comme la grossesse ou la période puerpérale (cf Grossesse et Allaitement) ;
- en cas d’anomalies génétiques identifiées des cholinestérases plasmatiques (cf ci-dessous et cf Contre-indications) ;
- en cas de tétanos sévère généralisé, de tuberculose ou d’autres infections sévères ou chroniques ;
- lors de maladie chronique débilitante, de tumeurs malignes, d’anémie chronique ou de malnutrition ;
- en cas de myxoedème ou de collagénose ;
- en cas de pathologie cardiaque décompensée ;
- en cas d’ulcère gastrique ;
- chez les brûlés (cf ci-dessous) ;
- en cas d’insuffisance hépatique au stade terminal (cf Posologie et Mode d’administration) ;
- en cas d’insuffisance rénale aiguë, chronique ou au stade terminal (cf Posologie et Mode d’administration) ;
- en cas de cause iatrogène : après un échange plasmatique, une plasmaphérèse, une circulation extracorporelle, ou après l’administration concomitante d’autres médicaments (cf Interactions).
Chez les patients porteurs d’une anomalie génétique des cholinestérases plasmatiques :
Comme avec la succinylcholine, les patients homozygotes ayant un déficit en cholinestérase plasmatique (1/2500 patients environ) sont extrêmement sensibles aux effets curarisants de Mivacron (cf Contre-indications). - en cas de modification physiologique comme la grossesse ou la période puerpérale (cf Grossesse et Allaitement) ;
- La décurarisation complète spontanée peut ne survenir qu’au bout de 12 heures.
- Chez les patients hétérozygotes ayant un déficit en cholinestérases plasmatiques, la durée de curarisation cliniquement efficace induite par une dose de mivacurium de 0,15 mg/kg est plus longue d’environ 10 minutes que chez les patients ayant une activité des cholinestérases plasmatiques normale.
- On peut observer, au cours de l’administration de mivacurium, une libération d’histamine. Le mivacurium doit être utilisé avec précautions chez les sujets atopiques ou sensibles aux effets de l’histamine comme, par exemple, chez l’asthmatique. Dans ce cas, l’administration se fait en plus de 60 secondes. Chez les sujets sensibles à une diminution de pression artérielle (hypovolémiques), le mivacurium doit être administré lentement en 60 secondes.
- Chez l’adulte, des doses supérieures ou égales à 0,2 mg/kg (3 × DE 95) ont été associées à des libérations d’histamine quand elles sont administrées par injection de bolus rapides. La libération d’histamine semble liée à la fois à la dose et à la vitesse d’administration. Une administration plus lente d’une dose de 0,2 mg/kg ou d’une dose de 0,25 mg/kg fractionnée diminue les effets cardiovasculaires.
- Aux doses recommandées, le mivacurium n’a pas d’effet significatif sur le système vagal ni d’effet ganglioplégique. Il n’a donc pas d’effet clinique significatif sur le rythme cardiaque et ne devrait pas antagoniser la bradycardie induite par la plupart des anesthésiques ou par la stimulation vagale au cours de l’acte chirurgical.
- Chez les patients insuffisants hépatiques graves et chez les patients traités par certains médicaments (cf Interactions) : la sensibilité au bloc neuromusculaire induit par le mivacurium est augmentée.
- Chez les brûlés, une résistance aux curares non dépolarisants peut apparaître et des doses plus importantes peuvent être nécessaires.
- Cependant, ces patients peuvent également avoir une activité cholinestérase plasmatique réduite, qui nécessite une diminution des doses.
En conséquence, il convient d’administrer à ces patients une dose test initiale de 0,015 à 0,020 mg/kg de Mivacron qui sera suivie d’une dose adaptée en fonction des données du monitorage du bloc avec un stimulateur de nerf périphérique.
INTERACTIONS |
Certaines substances peuvent modifier l’intensité et/ou la durée de l’effet des curares non dépolarisants.
- les anesthésiques volatils tels que isoflurane, enflurane, desflurane, sévoflurane ou halothane,
- les anesthésiques locaux,
- certains antibiotiques (aminosides, polymyxines, lincosanides, tétracyclines),
- le sulfate de magnésium (IV),
- le dantrolène,
- les antagonistes du calcium,
- les médicaments aggravant ou révélant une myasthénie latente, voire pouvant déclencher un syndrome myasthénique, comme la quinidine, le lithium.
GROSSESSE et ALLAITEMENT |
- Premier trimestre :
- Les études chez l’animal n’ont pas mis en évidence d’effet tératogène.
- En clinique, aucun effet malformatif ou foetotoxique particulier n’est apparu à ce jour. Toutefois, le suivi de grossesses exposées au mivacurium est insuffisant pour exclure tout risque.
- En conséquence, l’utilisation du mivacurium ne doit être envisagée au cours de la grossesse que si nécessaire.
- Fin de grossesse :
- La fin de grossesse doit être considérée, d’un point de vue anesthésique, comme un « estomac plein » exposant au syndrome de Mendelson (pneumopathie acide par inhalation du suc gastrique).
- Dans ces conditions, l’intubation doit être rapide et il importe de privilégier un curare à délai d’action bref (inférieur à 1 minute).
- Le relais peut ensuite être pris par un curare à action plus lente.
- Le passage transplacentaire des curares est faible et le risque de curarisation néonatale est exceptionnel.
Allaitement :
En l’absence de donnée, en cas d’administration de curare, l’allaitement doit être suspendu.
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
- Réactions anaphylactiques :
De très rares réactions anaphylactiques sévères ont été rapportées. - Des réactions anaphylactiques aux curares en général ont été décrites (parfois sévères, telles que choc, arrêt cardiaque). Bien que ces phénomènes ne se produisent que très rarement avec le mivacurium (cf supra), des précautions doivent toujours être prises pour pallier la survenue éventuelle de ces réactions. Il convient de prendre des précautions particulières dans les cas d’antécédents connus de réactions anaphylactiques aux curares, une réactivité allergique croisée pouvant se produire avec ces agents.
- Libération d’histamine et réactions histaminoïdes :
Les myorelaxants peuvent induire une libération d’histamine, à la fois aux niveaux local et systémique. De ce fait, il est possible qu’un prurit et des réactions érythémateuses apparaissent au site d’injection et/ou que des réactions histaminoïdes (anaphylactoïdes) systémiques telles que des bronchospasmes et des troubles cardiovasculaires se produisent après l’administration de ces produits. - Des effets indésirables liés à la libération d’histamine (éruptions cutanées dont érythèmes et urticaire, hypotension, tachycardie et bronchospasme transitoires) ont été rapportés. De très rares réactions anaphylactoïdes sévères ont été rapportées.
- Ces effets indésirables liés à la dose sont plus fréquents pour des doses initiales supérieures ou égales à 0,2 mg/kg administrées rapidement.
- L’administration lente en 30 à 60 secondes ou en dose fractionnée sur la même durée permet d’éviter ou de diminuer les effets indésirables.
- Des cas de curarisation prolongée jusqu’à 12 heures ont été rapportés (cf Mises en garde et Précautions d’emploi).
SURDOSAGE |
- Signes :
- Paralysie musculaire prolongée et ses conséquences respiratoires.
- Effets indésirables d’ordre hémodynamique : hypotension artérielle.
- Traitement :
- Il n’existe pas d’antidote ou d’antagoniste du mivacurium disponible en France. Dans tous les cas, maintenir une ventilation artificielle en pression positive jusqu’au retour de la respiration spontanée. Une sédation est nécessaire puisque la vigilance n’est pas altérée.
- Une assistance cardiovasculaire peut être éventuellement nécessaire avec utilisation de solutions de remplissage et de médicaments vasoconstricteurs.
PHARMACODYNAMIE |
Classe pharmacothérapeutique : curares (relaxant musculaire) ; code ATC : M03AC10 (M : système locomoteur).
Le mivacurium est un agent curarisant de courte durée d’action, d’environ 15 minutes, exerçant ses effets pharmacologiques par blocage non dépolarisant de la jonction neuromusculaire.
Le profil de réversion du mivacurium est très rapide et il ne s’accumule pas après administration répétée de doses d’entretien en l’absence de déficit en cholinestérases (pseudocholinestérases) plasmatiques.
PHARMACOCINÉTIQUE |
Après injection IV d’une dose curarisante, l’action du mivacurium est brève. La durée du bloc neuromusculaire induit est principalement dépendante de l’hydrolyse du produit par les pseudocholinestérases plasmatiques et secondairement par les estérases hépatiques. L’élimination des produits d’hydrolyse se fait principalement par voies biliaire et rénale.
Chez le sujet sain, le volume de distribution est faible et varie entre 0,065 et 0,15 l/kg. La clairance plasmatique totale est d’environ 40 à 70 ml/min/kg et la demi-vie d’élimination est d’environ 2 minutes.
Chez l’insuffisant hépatique terminal, la clairance plasmatique moyenne est plus faible (33,3 ml/min/kg) et la demi-vie d’élimination allongée (4,35 minutes), du fait de la diminution de l’activité des pseudocholinestérases plasmatiques mais il n’y a pas de variation du volume de distribution.
Chez l’insuffisant rénal terminal, la clairance plasmatique totale (76,6 ml/min/kg), le volume de distribution (0,15 l/kg) et la demi-vie d’élimination (1,8 min) ne sont pas significativement différents des paramètres retrouvés chez l’adulte sain.
Chez le sujet âgé, la clairance plasmatique (47 ml/min/kg), le volume de distribution (0,07 l/kg), la demi-vie d’élimination (1,7 min) ne sont pas significativement différents de ceux du sujet sain.
Chez le nourrisson de 2 à 6 mois et l’enfant de 7 mois à 12 ans, les paramètres pharmacocinétiques sont comparables à ceux obtenus chez l’adulte jeune.
INCOMPATIBILITÉS |
Ce médicament ne doit pas être mélangé avec d’autres médicaments à l’exception de ceux mentionnés dans la rubrique Posologie/Mode d’administration.
MODALITÉS DE CONSERVATION |
- Durée de conservation :
- 18 mois.
A conserver à une température inférieure à 25 °C et à l’abri de la lumière.
Ne pas congeler.
Après ouverture/reconstitution/dilution : cf Posologie et Mode d’administration.
MODALITÉS MANIPULATION/ÉLIMINATION |
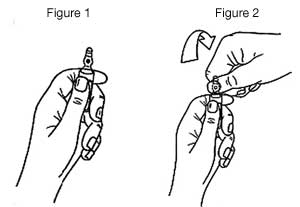
- Maintenir avec la main la partie inférieure de l’ampoule, comme indiqué sur la figure 1.
- Saisir la partie supérieure de l’ampoule avec l’autre main, le pouce posé sur le point coloré, et exercer une pression, comme indiqué sur la figure 2.
 |
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| Réservé à l’usage hospitalier. | |
| AMM | 3400956511624 (2003, RCP rév 12.03.2010) 10 mg/5 ml. |
| 3400955831013 (1994, RCP rév 19.03.2010) 20 mg/10 ml. | |
Collect.
Laboratoire GlaxoSmithKline
100, route de Versailles. 78163 Marly-le-Roi cdx
Tél : 01 39 17 80 00
Info médic :
Tél : 01 39 17 84 44. Fax : 01 39 17 84 45
Pharmacovigilance : Tél : 01 39 17 80 16
Liste Des Sections Les Plus Importantes :
- pathologies
- Medicaments
- Medicaments injectables
- Traitement D’Urgence
- Guide Infirmier Des Examens De Laboratoire
- Infirmiers En Urgences
- Fiche Technique Medical
- Techniques De Manipulations En Radiologie Medicale
- Bibliotheque_medicale



