indacatérol
FORMES et PRÉSENTATIONS |
COMPOSITION |
| p gélule | |
| Indacatérol (DCI) maléate exprimé en indacatérol | 150 µg |
| ou | 300 µg |
Teneur en lactose : 24,8 mg/gél à 150 µg ; 24,6 mg/gél à 300 µg.
La dose délivrée par l’embout buccal de l’inhalateur est de 120 µg (gél à 150 µg) ou de 240 µg (gél à 300 µg) d’indacatérol sous forme de maléate d’indacatérol.
INDICATIONS |
POSOLOGIE ET MODE D’ADMINISTRATION |
La dose recommandée est l’inhalation du contenu d’une gélule de 150 µg une fois par jour à l’aide de l’inhalateur Onbrez Breezhaler. La posologie ne doit être augmentée que sur avis médical.
L’inhalation du contenu d’une gélule de 300 µg une fois par jour à l’aide de l’inhalateur Onbrez Breezhaler peut apporter un bénéfice clinique supplémentaire pour diminuer l’essoufflement, en particulier chez les patients atteints de BPCO sévère. La dose maximale préconisée est de 300 µg une fois par jour.
Onbrez Breezhaler doit être administré quotidiennement à heure fixe dans la journée.
En cas d’omission d’une dose, la dose suivante doit être prise à l’heure habituelle le lendemain.
- Patients âgés :
- La concentration plasmatique maximale et l’exposition systémique totale augmentent avec l’âge, mais il n’est pas nécessaire d’adapter la posologie chez les patients âgés.
- Enfants et adolescents :
- Il n’y a pas d’indication spécifique pour l’utilisation d’Onbrez Breezhaler chez les enfants et adolescents (en dessous de 18 ans).
- Insuffisance hépatique :
- Il n’est pas nécessaire d’adapter la posologie chez les patients présentant une insuffisance hépatique légère à modérée. Il n’existe pas de données concernant l’administration d’Onbrez Breezhaler chez les patients atteints d’insuffisance hépatique sévère.
- Insuffisance rénale :
- Il n’est pas nécessaire d’adapter la posologie chez les patients présentant une insuffisance rénale.
Mode d’administration :
Pour inhalation seulement.
Les gélules Onbrez Breezhaler doivent être administrées en utilisant uniquement l’inhalateur Onbrez Breezhaler (cf Modalités de manipulation et d’élimination).
Les gélules Onbrez Breezhaler ne doivent pas être avalées.
CONTRE-INDICATIONS |
MISES EN GARDE et PRÉCAUTIONS D’EMPLOI |
- Asthme :
- Onbrez Breezhaler ne doit pas être utilisé chez les patients asthmatiques compte tenu de l’absence de données à long terme dans le traitement de l’asthme par Onbrez Breezhaler.
- Bronchospasme paradoxal :
- Comme avec tout médicament administré par voie inhalée, l’inhalation d’Onbrez Breezhaler peut entraîner un bronchospasme paradoxal pouvant engager le pronostic vital. En cas de bronchospasme paradoxal, le traitement par Onbrez Breezhaler doit être arrêté immédiatement et remplacé par un autre traitement.
- Aggravation de la maladie :
- Onbrez Breezhaler n’est pas indiqué dans le traitement des épisodes aigus de bronchospasme, c’est-à-dire en traitement de secours. En cas d’aggravation de la BPCO pendant le traitement par Onbrez Breezhaler, l’état du patient et la conduite thérapeutique de la BPCO devront être réévalués. La dose quotidienne d’Onbrez Breezhaler ne doit pas excéder la dose maximale de 300 µg.
- Effets systémiques :
- Bien qu’aucun effet cliniquement significatif sur l’appareil cardiovasculaire ne soit généralement observé après l’administration d’Onbrez Breezhaler aux doses recommandées, comme les autres agonistes bêta-2-adrénergiques, l’indacatérol doit être utilisé avec prudence chez les patients présentant des affections cardiovasculaires (maladie coronarienne, infarctus aigu du myocarde, arythmies, hypertension), chez les patients présentant des épisodes convulsifs ou une thyrotoxicose et chez les patients présentant une réponse idiosyncrasique aux agonistes bêta-2-adrénergiques.
- Effets cardiovasculaires :
- Comme les autres agonistes bêta-2-adrénergiques, l’indacatérol peut provoquer chez certains patients des effets cardiovasculaires cliniquement significatifs, se manifestant par des augmentations de la fréquence cardiaque et de la pression artérielle et/ou des symptômes. Dans ce cas, il peut être nécessaire d’interrompre le traitement. De plus, des modifications de l’électrocardiogramme telles qu’un aplatissement de l’onde T et un sous-décalage du segment ST ont été rapportées avec les agonistes bêta-2-adrénergiques, mais la pertinence clinique de ces observations est inconnue.
- Dans les études cliniques menées avec Onbrez Breezhaler administré aux doses thérapeutiques recommandées, il n’a pas été observé d’allongement de l’intervalle QTc cliniquement significatif (cf Pharmacodynamie).
- Hypokaliémie :
- Les agonistes bêta-2-adrénergiques peuvent induire chez certains patients une hypokaliémie significative, qui peut entraîner des effets indésirables cardiovasculaires. La diminution de la kaliémie est généralement transitoire et ne nécessite pas de supplémentation. Chez les patients présentant une BPCO sévère, les effets hypokaliémiants peuvent être potentialisés par l’hypoxie et par des traitements concomitants (cf Interactions), ce qui peut accroître la prédisposition aux arythmies cardiaques.
- Hyperglycémie :
- L’inhalation de doses élevées d’agonistes bêta-2-adrénergiques peut entraîner des élévations de la glycémie. La glycémie doit être surveillée plus étroitement chez les patients diabétiques après l’instauration du traitement par Onbrez Breezhaler.
- Lors des études cliniques, l’incidence de modifications cliniquement significatives de la glycémie a été généralement plus élevée de 1 à 2 % chez les patients traités par Onbrez Breezhaler aux doses recommandées que chez les patients sous placebo. Onbrez Breezhaler n’a pas été étudié chez les patients présentant un diabète mal contrôlé.
INTERACTIONS |
- Agents sympathomimétiques :
- L’administration concomitante d’autres sympathomimétiques (seuls ou dans le cadre d’un traitement en association) peut potentialiser les effets indésirables d’Onbrez Breezhaler.
- Onbrez Breezhaler ne doit pas être utilisé en association avec d’autres agonistes bêta-2-adrénergiques à longue durée d’action ou avec des médicaments contenant des agonistes bêta-2-adrénergiques à longue durée d’action.
- Traitement hypokaliémiant :
- L’effet hypokaliémiant possible des agonistes bêta-2-adrénergiques peut être potentialisé en cas de traitement concomitant par des agents hypokaliémiants tels que les dérivés de la méthylxanthine, les corticoïdes ou les diurétiques non épargneurs de potassium ; ceux-ci devront donc être utilisés avec précaution (cf Mises en garde et Précautions d’emploi).
- Bêtabloquants :
- Les bêtabloquants peuvent diminuer ou antagoniser l’effet des agonistes bêta-2-adrénergiques. L’indacatérol ne doit donc pas être administré avec des bêtabloquants (y compris des collyres) à moins d’une nécessité absolue. Si leur utilisation s’avère indispensable, il est préférable d’utiliser des bêtabloquants cardiosélectifs, mais ils devront être administrés avec prudence.
- Interactions métaboliques et avec les transporteurs :
- L’inhibition des principaux responsables de l’élimination de l’indacatérol, le CYP3A4 et la glycoprotéine P (Gp), multiplie par près de 2 fois l’exposition systémique à l’indacatérol. Compte tenu des données relatives à la sécurité d’emploi du traitement par Onbrez Breezhaler issues des études cliniques d’une durée allant jusqu’à un an, menées avec des doses représentant jusqu’à 2 fois la dose thérapeutique recommandée, l’amplitude de l’augmentation de l’exposition due à des interactions n’entraîne pas de risque.
- Il n’a pas été mis en évidence d’interactions de l’indacatérol avec des médicaments administrés en association. Les études in vitro ont montré que l’indacatérol présente un potentiel négligeable d’interactions médicamenteuses aux niveaux d’exposition systémique observés aux doses thérapeutiques préconisées.
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Il n’existe pas de données suffisamment pertinentes concernant l’utilisation de l’indacatérol chez la femme enceinte. Les études chez l’animal n’ont pas montré d’effets délétères directs ou indirects sur la reproduction à des niveaux d’exposition similaires à ceux observés aux doses thérapeutiques (cf Sécurité préclinique). Comme les autres agonistes bêta-2-adrénergiques, l’indacatérol peut inhiber le travail au moment de l’accouchement par effet relaxant sur le muscle lisse utérin. Onbrez Breezhaler ne doit être utilisé pendant la grossesse que si les bénéfices attendus l’emportent sur les risques potentiels.
Allaitement :
Le passage dans le lait maternel humain de l’indacatérol et/ou de ses métabolites n’est pas établi. Les études pharmacocinétiques et toxicologiques chez l’animal ont montré une excrétion de l’indacatérol et de ses métabolites dans le lait (cf Sécurité préclinique). Un risque pour l’enfant allaité ne peut pas être exclu. Il convient d’interrompre l’allaitement ou d’interrompre/suspendre le traitement par Onbrez Breezhaler, en prenant en considération le bénéfice de l’allaitement pour l’enfant et le bénéfice attendu du traitement pour la mère.
Fertilité :Une diminution du taux de gestation a été observée chez le rat. Néanmoins, il est peu probable que l’indacatérol ait des effets sur les fonctions de reproduction ou la fertilité humaines en cas d’inhalation de la dose maximale recommandée (cf Sécurité préclinique).
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
- Synthèse du profil de sécurité d’emploi :
- Les effets indésirables les plus fréquents aux doses recommandées ont été : rhinopharyngite (9,1 %), toux (6,8 %), infections respiratoires hautes (6,2 %), et céphalées (4,8 %). Dans la plupart des cas, ils ont été d’intensité légère ou modérée et leur fréquence diminuait avec la poursuite du traitement.
- Aux doses recommandées, le profil d’effets indésirables d’Onbrez Breezhaler chez les patients atteints de BPCO montre des effets systémiques sans répercussions cliniques significatives de la stimulation des récepteurs bêta-2-adrénergiques. Les modifications de la fréquence cardiaque ont été en moyenne inférieures à une pulsation par minute et les cas de tachycardie ont été peu fréquents et rapportés à une incidence comparable à celle observée avec le placebo. Il n’a pas été détecté d’allongements significatifs de l’intervalle QTcF par rapport au placebo. La fréquence d’intervalle QTcF notable (soit > 450 ms chez les hommes et > 470 ms chez les femmes) et les cas d’hypokaliémie ont été comparables à ceux observés sous placebo. Les variations maximales de la glycémie ont été en moyenne comparables avec Onbrez Breezhaler par rapport au placebo.
- Synthèse des effets indésirables :
- Le programme de développement clinique de phase III d’Onbrez Breezhaler a été mené chez des patients ayant un diagnostic clinique de BPCO modérée à sévère. Au total, 2154 patients ont été exposés à l’indacatérol pendant des durées allant jusqu’à un an à des doses représentant jusqu’à deux fois la dose maximale recommandée. Chez ces patients, 627 ont été traités avec 150 µg une fois par jour, et 853 avec 300 µg une fois par jour. Environ 40 % des patients présentaient une BPCO sévère. L’âge moyen des patients était de 63 ans, 47 % d’entre eux étant âgés de 65 ans ou plus, et les patients étaient majoritairement caucasiens (89 %).
- Les effets indésirables sont présentés ci-dessous selon la classification par classes d’organes MedDRA dans la base de données de sécurité d’emploi dans la BPCO. Au sein de chaque classe d’organes, les effets indésirables sont classés par fréquence en ordre décroissant selon la convention suivante (CIOMS III) : très fréquent (>= 1/10) ; fréquent (>= 1/100, < 1/10) ; peu fréquent (>= 1/1000, < 1/100) ; rare (>= 1/10 000, < 1/1000) ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
- Infections et infestations :
- Fréquent : Rhinopharyngite, infection respiratoire haute, sinusite.
- Fréquent : Rhinopharyngite, infection respiratoire haute, sinusite.
- Troubles du métabolisme et de la nutrition :
- Fréquent : Diabète, hyperglycémie.
- Fréquent : Diabète, hyperglycémie.
- Affections du système nerveux :
- Fréquent : Céphalées.
- Peu fréquent : Paresthésies.
- Fréquent : Céphalées.
- Affections cardiaques :
- Fréquent : Cardiopathie ischémique.
- Peu fréquent : Fibrillation auriculaire.
- Fréquent : Cardiopathie ischémique.
- Affections respiratoires, thoraciques et médiastinales :
- Fréquent : Toux, douleur laryngopharyngée, rhinorrhée, congestion des voies respiratoires.
- Fréquent : Toux, douleur laryngopharyngée, rhinorrhée, congestion des voies respiratoires.
- Affections musculosquelettiques et systémiques :
- Fréquent : Spasmes musculaires.
- Fréquent : Spasmes musculaires.
- Troubles généraux et anomalies au site d’administration :
- Fréquent : OEdème périphérique.
- Peu fréquent : Douleur thoracique non cardiaque.
- Fréquent : OEdème périphérique.
- Globalement, le profil de sécurité d’emploi d’Onbrez Breezhaler administré à raison de deux fois la dose maximale recommandée a été comparable à celui rapporté lors de l’administration des doses recommandées. Les effets indésirables supplémentaires ont été des tremblements (fréquents) et une anémie (peu fréquente).
- Description des effets indésirables sélectionnés :
- Dans les études cliniques de phase III, les professionnels de santé ont observé lors des visites cliniques que 17 à 20 % des patients en moyenne présentaient une toux sporadique qui survenait habituellement dans les 15 secondes suivant l’inhalation et qui durait généralement 5 secondes (environ 10 secondes chez les fumeurs). Sa fréquence était plus élevée chez les femmes que chez les hommes et chez les fumeurs que chez les anciens fumeurs. En général, cette toux suivant l’inhalation a été bien tolérée et n’a entraîné la sortie prématurée d’aucun patient des études menées aux doses recommandées (la toux est un symptôme de la BPCO et 6,8 % seulement des patients au total ont rapporté une toux en tant qu’événement indésirable). Il n’existe pas de données indiquant que la toux survenant après l’inhalation soit associée à un bronchospasme, à des exacerbations, à une aggravation de la maladie ou à un manque d’efficacité.
SURDOSAGE |
PHARMACODYNAMIE |
Classe pharmacothérapeutique : Agonistes bêta-2-adrénergiques de longue durée d’action (code ATC : R03AC18).
- Mécanisme d’action :
- Les effets pharmacologiques des agonistes bêta-2-adrénergiques sont imputables au moins en partie à la stimulation de l’adénylcyclase intracellulaire, l’enzyme qui catalyse la conversion de l’adénosine triphosphate (ATP) en adénosine monophosphate-3′,5′ cyclique (AMP cyclique). L’augmentation du taux d’AMP cyclique entraîne une relaxation du muscle lisse bronchique. Des études in vitro ont indiqué que l’indacatérol, un agoniste bêta-2-adrénergique à longue durée d’action, présente une activité agoniste plus de 24 fois supérieure sur les récepteurs bêta-2 que sur les récepteurs bêta-1 et 20 fois plus élevée que sur les récepteurs bêta-3.
- Lorsqu’il est inhalé, l’indacatérol exerce un effet bronchodilatateur local dans les poumons. L’indacatérol est un agoniste partiel des récepteurs bêta-2-adrénergiques humains ayant une activité nanomolaire. Dans les bronches humaines isolées, l’indacatérol a un délai d’action rapide et une longue durée d’action.
- Bien que les récepteurs bêta-2-adrénergiques soient les récepteurs adrénergiques prédominants dans le muscle lisse bronchique et que les récepteurs bêta-1 soient prédominants dans le muscle cardiaque, il existe également des récepteurs bêta-2-adrénergiques dans le coeur humain, qui représentent 10 à 50 % de tous les récepteurs adrénergiques. La fonction précise des récepteurs bêta-2-adrénergiques dans le coeur n’est pas connue mais, du fait de leur présence, il existe une possibilité que même des agonistes bêta-2-adrénergiques hautement sélectifs puissent avoir des effets cardiaques.
- Effets pharmacodynamiques :
- Dans de nombreuses études de pharmacodynamie et d’efficacité clinique, Onbrez Breezhaler, administré une fois par jour aux doses de 150 et 300 µg, a induit de façon uniforme des améliorations cliniquement significatives de la fonction pulmonaire (mesurée par le volume expiratoire maximum par seconde, VEMS) pendant 24 heures. Il a été observé un délai d’action rapide, dans les 5 minutes suivant l’inhalation, avec une augmentation du VEMS par rapport aux valeurs initiales de 110 à 160 ml, comparable à l’effet de l’agoniste bêta-2-adrénergique d’action rapide salbutamol 200 µg, et une rapidité d’action supérieure statistiquement significative à celle du salmétérol/fluticasone 50/500 µg. Les améliorations moyennes du VEMS par rapport aux valeurs initiales ont été de 250-330 ml à l’état d’équilibre.
- L’effet bronchodilatateur n’a pas été dépendant du moment d’administration (matin ou soir).
- Onbrez Breezhaler a montré une réduction de la distension pulmonaire, entraînant une augmentation de la capacité inspiratoire pendant l’effort et au repos, par rapport au placebo.
-
- Effets sur l’électrophysiologie cardiaque :
- Une étude en double aveugle contrôlée contre placebo et contre comparateur actif (moxifloxacine) de 2 semaines chez 404 volontaires sains a montré des allongements moyens maximaux (intervalles de confiance à 90 %) de l’intervalle QTcF (en millisecondes) de respectivement 2,66 (0,55, 4,77), 2,98 (1,02, 4,93) et 3,34 (0,86, 5,82) après l’administration de doses répétées de 150 µg, 300 µg et 600 µg. Il n’existe donc pas de risque d’un potentiel proarythmique lié à des allongements de l’intervalle QT aux doses thérapeutiques recommandées ou à une dose représentant deux fois la dose maximale recommandée. Il n’a pas été retrouvé de relation de dose à effet entre les concentrations et les variations (delta) du QTc dans l’intervalle de doses évaluées.
- Chez 605 patients atteints de BPCO dans une étude de phase III en double aveugle contrôlée contre placebo de 26 semaines, il n’a pas été observé de différence cliniquement significative dans la survenue d’événements arythmiques surveillés pendant 24 heures, au début de l’étude et jusqu’à trois temps d’évaluation pendant la période de traitement de 26 semaines, entre les patients recevant les doses recommandées d’Onbrez Breezhaler et ceux qui avaient reçu le placebo ou un traitement par le tiotropium.
- Efficacité clinique et sécurité d’emploi :
- Le programme de développement clinique incluait une étude randomisée contrôlée de 12 semaines, deux études de 6 mois (dont une a été étendue à un an pour évaluer la sécurité d’emploi et la tolérance), et une étude d’un an chez des patients ayant un diagnostic clinique de BPCO. Ces études incluaient des mesures de la fonction pulmonaire, des critères tels que la dyspnée et les exacerbations, et la qualité de vie liée à la santé.
-
- Fonction pulmonaire :
- Onbrez Breezhaler, administré une fois par jour aux doses de 150 µg et 300 µg, a entraîné des améliorations cliniquement significatives de la fonction pulmonaire. Pour le critère d’évaluation principal à 12 semaines (VEMS de base sur 24 heures), la dose de 150 µg a permis d’obtenir une augmentation moyenne de 130 à 180 ml par rapport au placebo (p < 0,001), et de 60 ml par rapport au salmétérol 50 µg deux fois par jour (p < 0,001). La dose de 300 µg a induit une augmentation de 170 à 180 ml par rapport au placebo (p < 0,001), et de 100 ml par rapport au formotérol 12 µg deux fois par jour (p < 0,001). Les deux doses ont induit une augmentation de 40 à 50 ml par rapport au tiotropium 18 µg une fois par jour administré en ouvert (150 µg, p = 0,004 ; 300 µg, p = 0,01). L’effet bronchodilatateur sur 24 heures d’Onbrez Breezhaler a été maintenu à partir de la première dose sur toute la période de traitement d’un an sans signes de perte d’efficacité (tachyphylaxie).
-
- Amélioration des symptômes :
- Les deux doses ont montré des améliorations statistiquement et cliniquement significatives du soulagement des symptômes par rapport au placebo pour la dyspnée et l’état de santé (évalués respectivement par les questionnaires Transitional Dyspnoea Index [TDI] et St. George’s Respiratory Questionnaire [SGRQ]). L’amplitude de la réponse était généralement plus grande que celle des comparateurs actifs (cf tableau 1). De plus, chez les patients traités par Onbrez Breezhaler, le recours à un traitement de secours a été significativement moins fréquent, la nécessité d’un traitement de secours a été significativement inférieure par rapport au placebo, et le pourcentage de jours sans symptômes diurnes a été significativement plus élevé.
- Une analyse réunissant l’ensemble des résultats d’efficacité à 6 mois a montré que le taux d’exacerbation de la BPCO avec le traitement était significativement plus faible qu’avec le placebo. La comparaison du traitement au placebo a montré un rapport des taux de 0,68 (IC 95 % [0,47, 0,98] ; p = 0,036) et 0,74 (IC 95 % [0,56, 0,96] ; p = 0,026) respectivement pour les doses de 150 µg et 300 µg.
- L’expérience concernant le traitement chez les personnes d’origine africaine est limitée.
-
Tableau 1 : Soulagement des symptômes après 6 mois de traitement Dose du traitement Indacatérol 150 µg 1 fois/jour Indacatérol 300 µg 1 fois/jour Tiotropium 18 µg 1 fois/jour Salmétérol 50 µg 2 fois/jour Formotérol 12 µg 2 fois/jour Placebo Pourcentage de patients ayant obtenu la DMCS sur le TDI* 57(a) 54(a) 45(a) 62(b) 71(b) 57(b) 47(b) 59(c) 54(c) 41(c) Pourcentage de patients ayant obtenu la DMCS sur le SGRQ* 53(a) 49(a) 38(a) 58(b) 53(b) 47(b) 46(b) 55(c) 51(c) 40(c) Réduction du nombre de bouffées/jour du médicament de secours par rapport au début de l’étude 1,3(a) 1,2(a) 0,3(a) 1,5(b) 1,6(b) 1,0(b) n/e 0,4(b) Pourcentage de jours sans recours au médicament de secours 60(a) 55(a) 42(a) 57(b) 58(b) 46(b) n/e 42(b) - n/e : non évalué à 6 mois
-
*
DMCS : différence minimale cliniquement significative (modification >= 1 point sur le TDI, >= 4 points sur le SGRQ).
-
(a)
Étude menée avec : indacatérol 150 µg, salmétérol et placebo.
-
(b)
Étude menée avec : indacatérol 150 et 300 µg, tiotropium et placebo.
-
(c)
Étude menée avec : indacatérol 300 µg, formotérol et placebo.
- Population pédiatrique :
- L’Agence européenne du médicament a accordé une dérogation concernant l’obligation de soumettre les résultats des études avec Onbrez Breezhaler dans toutes les tranches de la population pédiatrique pour le traitement de la bronchopneumopathie chronique obstructive (cf Posologie et Mode d’administration pour des informations sur l’utilisation en pédiatrie).
PHARMACOCINÉTIQUE |
L’indacatérol est une molécule chirale avec une configuration R.
Les données pharmacocinétiques sont issues de plusieurs études cliniques menées chez des volontaires sains et des patients atteints de BPCO.
- Absorption :
- Après administration de doses inhalées uniques ou répétées, le temps médian jusqu’à la concentration sérique maximale est d’environ 15 minutes. L’exposition systémique à l’indacatérol augmente avec la dose (de 150 µg à 600 µg) de façon dose-proportionnelle. Après administration d’une dose inhalée, la biodisponibilité absolue de l’indacatérol est en moyenne de 43 % à 45 %. L’exposition systémique résulte pour environ 75 % d’une absorption pulmonaire et pour environ 25 % d’une absorption gastro-intestinale.
- La concentration sérique d’indacatérol augmente en cas d’administrations quotidiennes répétées. L’état d’équilibre est atteint en 12 à 14 jours. Le taux d’accumulation moyen de l’indacatérol, évalué par l’aire sous la courbe des concentrations plasmatiques mesurées sur un intervalle de 24 heures, pour des administrations en une prise quotidienne de doses allant de 150 µg à 600 µg du 1er au 14e jour, était de 2,9 à 3,5.
- Distribution :
- Après une perfusion intraveineuse, le volume de distribution de l’indacatérol pendant la phase terminale d’élimination est de 2557 litres, ce qui indique une distribution importante. La liaison aux protéines sériques et plasmatiques humaines in vitro est respectivement de 94,1 % à 95,3 %, et de 95,1 % à 96,2 %.
- Métabolisme :
- Après administration orale d’indacatérol radiomarqué dans une étude ADME (absorption, distribution, métabolisme, excrétion), le principal composant détecté dans le sérum a été l’indacatérol sous forme inchangée, représentant près d’un tiers de l’exposition totale au médicament sur 24 heures. Le principal métabolite retrouvé dans le sérum a été un dérivé hydroxylé. Les autres métabolites prédominants étaient des O-glycuroconjugués phénoliques d’indacatérol et l’indacatérol hydroxylé. Un diastéréomère du dérivé hydroxylé, un N-glycuroconjugué d’indacatérol et des produits C et N-désalkylés ont été les autres métabolites identifiés.
- Les études in vitro ont indiqué que l’UGT1A1 est la seule isoforme de l’UGT métabolisant l’indacatérol en O-glycuroconjugué phénolique. Des métabolites oxydatifs ont été détectés dans les incubations avec les isoenzymes CYP1A1, CYP2D6 et CYP3A4 recombinantes. Il en a été conclu que le CYP3A4 était la principale isoenzyme responsable de l’hydroxylation de l’indacatérol. Les études in vitro ont également indiqué que l’indacatérol est un substrat à faible affinité de la pompe d’efflux P-gp.
- Élimination :
- Dans les études cliniques qui incluaient un recueil d’urines, la quantité d’indacatérol excrété sous forme inchangée dans les urines a été généralement inférieure à 2 % de la dose. La clairance rénale de l’indacatérol a été en moyenne de 0,46 à 1,20 litre/heure. En comparaison avec la clairance sérique de l’indacatérol qui est de 23,3 litres/heure, il est évident que l’élimination rénale joue un rôle mineur (2 à 5 % environ de la clairance systémique) dans l’élimination de l’indacatérol disponible au niveau systémique.
- Dans une étude ADME chez l’homme au cours de laquelle l’indacatérol a été administré par voie orale, l’excrétion fécale a prédominé sur l’élimination par voie urinaire. L’indacatérol a été excrété dans les fèces essentiellement sous forme de substance mère inchangée (54 % de la dose) et, dans une moindre mesure, de métabolites hydroxylés (23 % de la dose). L’équilibre de masse a été complet avec plus de 90 % de la dose retrouvés dans les excreta.
- La concentration sérique d’indacatérol diminue de façon multiphasique avec une demi-vie terminale de l’ordre de 45,5 à 126 heures. La demi-vie effective, calculée à partir de l’accumulation d’indacatérol après des administrations répétées, est de 40 à 52 heures, ce qui est cohérent avec le temps jusqu’à l’état d’équilibre observé d’environ 12 à 14 jours.
- Populations particulières :
- Une analyse pharmacocinétique de population a montré que l’âge (adultes jusqu’à 88 ans), le sexe, le poids (32-168 kg) ou la race n’avaient pas d’effet cliniquement pertinent sur la pharmacocinétique de l’indacatérol. L’étude n’a pas indiqué de différence entre les sous-groupes ethniques dans cette population.
- Il n’a pas été observé de modifications significatives de la Cmax ou de l’ASC de l’indacatérol chez les patients présentant une insuffisance hépatique légère à modérée ni de différence dans la liaison aux protéines entre les sujets atteints d’insuffisance hépatique légère ou modérée et les témoins sains. Il n’a pas été mené d’études chez des sujets présentant une insuffisance hépatique sévère.
- Étant donné la très faible contribution de la voie urinaire à la clairance corporelle totale, il n’a pas été mené d’étude chez des sujets atteints d’insuffisance rénale.
SÉCURITE PRÉCLINIQUE |
Chez le chien, les effets sur l’appareil cardiovasculaire imputables aux propriétés bêta-2-agonistes de l’indacatérol ont été une tachycardie, des arythmies et des lésions myocardiques. Une irritation légère de la cavité nasale et du larynx a été observée chez les rongeurs. Tous ces effets sont survenus à des expositions largement supérieures à celles attendues chez l’homme.
Bien que l’indacatérol n’ait pas affecté les fonctions de reproduction générales dans une étude de fertilité chez le rat, une diminution du nombre de rates gravides à la génération F1 a été observée lors d’une étude péri- et post-développement chez le rat à une exposition 14 fois plus élevée que celle observée chez l’homme lors du traitement avec Onbrez Breezhaler. L’indacatérol n’a pas été embryotoxique ou tératogène chez le rat ou le lapin.
Les études de génotoxicité n’ont pas révélé de potentiel mutagène ou clastogène. La carcinogénicité a été évaluée dans une étude de deux ans chez le rat et dans une étude de six mois chez une souris transgénique. Les incidences accrues de léiomyomes ovariens bénins et d’hyperplasie focale du muscle lisse de l’ovaire chez la rate ont concordé avec les observations similaires rapportées pour d’autres agonistes bêta-2 adrénergiques. Aucun signe de carcinogénicité n’a été observé chez la souris. Dans les études chez le rat et la souris, les expositions systémiques (ASC) à la dose sans effet indésirable observé (DSEO) ont été supérieures d’au moins 7 et 49 fois respectivement à celles observées chez des sujets traités par Onbrez Breezhaler une fois par jour à la dose de 300 µg.
MODALITÉS DE CONSERVATION |
- Durée de conservation :
- 2 ans.
A conserver à une température ne dépassant pas 30 °C.
Les gélules d’Onbrez Breezhaler doivent toujours être conservées dans la plaquette thermoformée à l’abri de l’humidité et ne doivent être sorties de la plaquette qu’immédiatement avant utilisation.
MODALITÉS MANIPULATION/ÉLIMINATION |
Utiliser l’inhalateur Onbrez Breezhaler délivré lors de chaque renouvellement de la prescription. Jeter chaque inhalateur après 30 jours d’utilisation.
Instructions pour l’utilisation et la manipulation :- Retirer le capuchon.
- Ouvrir l’inhalateur : tenir fermement la base de l’inhalateur et incliner l’embout buccal, l’inhalateur est alors ouvert.
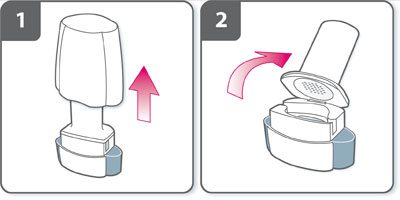
- Préparer la gélule : immédiatement avant utilisation, avec les mains sèches, sortir une gélule de la plaquette thermoformée.
- Insérer la gélule : placer la gélule dans son logement. Ne jamais placer une gélule directement dans l’embout buccal.
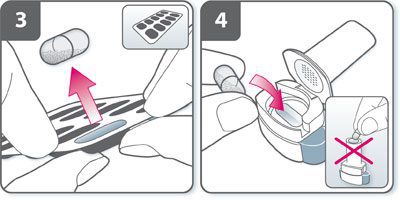
- Fermer l’inhalateur : refermer l’inhalateur jusqu’à ce qu’un « clic » soit entendu.
- Percer la gélule :
- Tenir l’inhalateur en position verticale avec l’embout buccal vers le haut.
- Percer la gélule en appuyant fermement sur les deux boutons latéraux en même temps. Cette étape ne doit être effectuée qu’une fois.
- Un « clic » doit être entendu lorsque la gélule est percée.
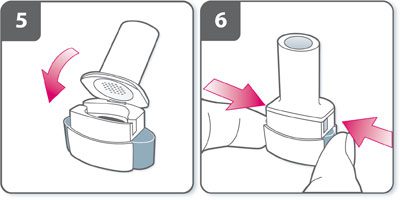
- Tenir l’inhalateur en position verticale avec l’embout buccal vers le haut.
- Relâcher complètement les boutons latéraux.
- Expirer à fond avant de placer l’embout buccal dans la bouche. Ne pas souffler dans l’embout buccal.
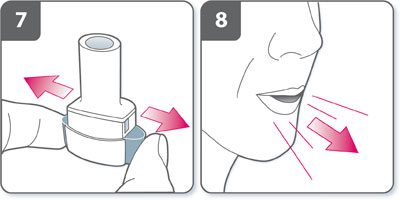
- Inhaler le médicament. Pour inhaler profondément le médicament dans les voies respiratoires :
- Tenir l’inhalateur : les boutons latéraux doivent être orientés vers la gauche et la droite. Ne pas appuyer sur les boutons latéraux.
- Placer l’embout buccal dans la bouche et serrer les lèvres.
- Inspirer rapidement mais régulièrement et aussi profondément que possible.
- Tenir l’inhalateur : les boutons latéraux doivent être orientés vers la gauche et la droite. Ne pas appuyer sur les boutons latéraux.
- Note :
Lors de l’inspiration dans l’inhalateur, la gélule tourne dans le logement et un bourdonnement doit se faire entendre. Un goût sucré est perçu lorsque le médicament pénètre dans les poumons. - Des morceaux minuscules de la gélule peuvent parfois traverser le filtre et entrer dans la bouche. Si cela se produit, ces morceaux pourront être perçus sur la langue. Le fait d’avaler ou d’inhaler ces morceaux ne présente aucun risque. La possibilité de rupture de la gélule est augmentée si la gélule est percée accidentellement plus d’une fois (étape 6).
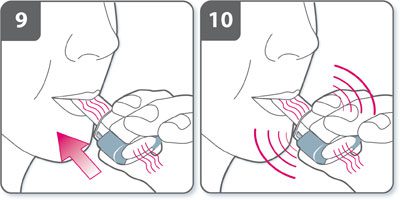
- Si un bourdonnement ne se fait pas entendre, la gélule est peut-être coincée dans son logement. Dans ce cas :
- Ouvrir l’inhalateur et libérer avec précaution la gélule en tapotant la base de l’inhalateur. Ne pas appuyer sur les boutons latéraux.
- Inhaler à nouveau le médicament en répétant les étapes 8 et 9.
- Ouvrir l’inhalateur et libérer avec précaution la gélule en tapotant la base de l’inhalateur. Ne pas appuyer sur les boutons latéraux.
- Retenir sa respiration. Après avoir inhalé le médicament :
- Retirer l’inhalateur de la bouche et retenir sa respiration pendant au moins 5 à 10 secondes ou aussi longtemps que possible.
- Expirer ensuite.
- Ouvrir l’inhalateur pour voir s’il reste de la poudre dans la gélule.
- S’il reste de la poudre dans la gélule : fermer l’inhalateur, et répéter les étapes 8, 9, 10 et 11.
- En général, la gélule peut être vidée en une ou deux inhalations.
- Retirer l’inhalateur de la bouche et retenir sa respiration pendant au moins 5 à 10 secondes ou aussi longtemps que possible.
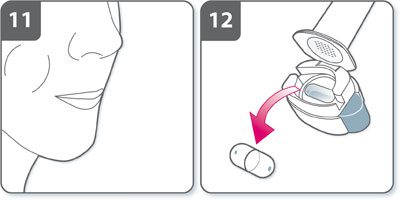
- Une fois l’inhalation terminée :
- Ouvrir à nouveau l’embout buccal et retirer la gélule vide en la faisant basculer hors de son logement. Jeter la gélule vide avec les ordures ménagères.
- Fermer l’inhalateur et replacer le capuchon.
- Ouvrir à nouveau l’embout buccal et retirer la gélule vide en la faisant basculer hors de son logement. Jeter la gélule vide avec les ordures ménagères.
- Marquer la réglette de suivi des doses quotidiennes :
La boîte contient une réglette de suivi des doses quotidiennes. Noter une croix dans la case du jour si cela aide à se rappeler quand la prochaine dose doit être inhalée.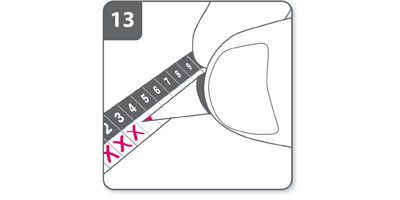
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM | EU/1/09/593/001 ; CIP 3400939982175 (RCP rév 16.12.2010) 10 gél 150 µg + inhalateur. |
| EU/1/09/593/002 ; CIP 3400939982236 (RCP rév 16.12.2010) 30 gél 150 µg + inhalateur. | |
| EU/1/09/593/006 ; CIP 3400939982465 (RCP rév 16.12.2010) 10 gél 300 µg + inhalateur. | |
| EU/1/09/593/007 ; CIP 3400939982526 (RCP rév 16.12.2010) 30 gél 300 µg + inhalateur. |
| Non remb Séc soc. |
Titulaire de l’AMM : Novartis Europharm Limited, Wimblehurst Road, Horsham. West Sussex. RH12 5AB. Royaume-Uni.
Novartis Pharma SAS
2-4, rue Lionel-Terray. 92500 Rueil-Malmaison
Tél : 01 55 47 60 00
Information et Communication Médicales :
Tél : 01 55 47 66 00 E-mail : icm.phfr@novartis.com
Site web : http://www.novartis.fr
Liste Des Sections Les Plus Importantes :
- pathologies
- Medicaments
- Medicaments injectables
- Traitement D’Urgence
- Guide Infirmier Des Examens De Laboratoire
- Infirmiers En Urgences
- Fiche Technique Medical
- Techniques De Manipulations En Radiologie Medicale
- Bibliotheque_medicale



