bésilate d’atracurium
FORMES et PRÉSENTATIONS |
COMPOSITION |
| p ampoule | p flacon | ||
| de 2,5 ml | de 5 ml | 25 ml | |
| Bésilate d’atracurium (DCI) | 25 mg | 50 mg | 250 mg |
INDICATIONS |
POSOLOGIE ET MODE D’ADMINISTRATION |
- Utilisation en anesthésie :
- Adulte et enfant de plus de trois mois :
- Injection IV :
La dose de 0,6 mg/kg procure de bonnes conditions d’intubation, en général au bout de 2 minutes. - 0,3 à 0,6 mg/kg (selon la durée de la curarisation souhaitée) induisent une curarisation profonde de 15 à 35 minutes. Comme avec tous les curares, la décurarisation spontanée complète requiert un délai supplémentaire : l’index de récupération (25-75 %) est de 10-15 minutes, le temps de récupération à 95 % mesuré à partir des premiers signes de décurarisation est d’environ 35 minutes. La réversion peut être accélérée par la néostigmine (associée à l’atropine). Le bloc peut être prolongé par des doses d’entretien de 0,1 à 0,2 mg/kg.
- Perfusion continue :
Après un bolus initial de 0,3 à 0,6 mg/kg, l’atracurium maintient un bloc neuromusculaire adéquat, lors d’interventions chirurgicales prolongées, en perfusion continue de 0,3 à 0,6 mg/kg/h ; après perfusion, l’index de récupération (25-75 %) est de 10 à 15 minutes, il est semblable à celui observé après injection discontinue. Lors d’interventions chirurgicales nécessitant une circulation extracorporelle, l’hypothermie (à 25-26 °C) peut diminuer la vitesse d’inactivation de l’atracurium. Le débit de perfusion doit alors être diminué de moitié. Dans tous les cas, le monitorage neuromusculaire est utile.
- Injection IV :
- Enfant de moins de trois mois :
- Les doses de 0,3 à 0,6 mg/kg en injection IV ou 0,3 à 0,6 mg/kg/h en perfusion entraînent une curarisation un peu plus longue que chez l’adulte. Il convient donc d’adapter la posologie et de tenir compte de la plus grande variabilité individuelle de la réponse aux curares dans cette tranche d’âge. L’utilisation en perfusion nécessite un monitorage neuromusculaire.
- Au-dessous d’un mois : il est prudent de réduire encore la posologie.
- Les doses de 0,3 à 0,6 mg/kg en injection IV ou 0,3 à 0,6 mg/kg/h en perfusion entraînent une curarisation un peu plus longue que chez l’adulte. Il convient donc d’adapter la posologie et de tenir compte de la plus grande variabilité individuelle de la réponse aux curares dans cette tranche d’âge. L’utilisation en perfusion nécessite un monitorage neuromusculaire.
- Utilisation en réanimation :
- Après un bolus initial de 0,3 à 0,6 mg/kg, l’atracurium maintient un bloc neuromusculaire adéquat en perfusion continue de 0,65 à 0,78 mg/kg/heure. Néanmoins, il existe une grande variabilité individuelle. La posologie peut évoluer avec le temps. Des débits de perfusion aussi faibles que 0,27 mg/kg/heure ou aussi élevés que 1,77 mg/kg/heure sont nécessaires chez certains patients. Le temps de récupération après une perfusion d’atracurium en réanimation est indépendant de la durée d’administration. La récupération spontanée jusqu’à un T4/T1 > 0,75 (proportion de la hauteur de la quatrième stimulation par rapport à la première d’un train-de-quatre) se produit en moyenne en 60 minutes (fourchette de 32 à 108 minutes).
- Sujet âgé :
- Aucune modification de posologie n’est nécessaire chez le sujet âgé. Il est néanmoins recommandé que la dose initiale corresponde à une dose minimale. Celle-ci doit être administrée en injection lente.
- Insuffisant rénal ou hépatique :
- Aucune modification de posologie n’est nécessaire en cas d’insuffisance rénale ou hépatique, même sévère.
- Sujet atteint d’une pathologie cardiovasculaire :
- Chez ce type de patients, la dose initiale d’atracurium doit être administrée en injection lente de plus de 60 secondes.
Mode d’administration :
Cette solution d’atracurium est compatible avec les liquides de perfusion suivants (concentrations de 0,5 à 0,9 mg/ml et température inférieure à 30 °C) :
- Durée de stabilité dans les liquides :
- Solution de chlorure de sodium (0,9 %) : 24 h.
- Solution glucosée (5 %) : 8 h.
- Liquide de Ringer : 8 h.
- Solution glucosée (4 %) sodique (0,18 %) : 8 h.
- Solution de lactate de sodium : 4 h.
Ne pas mélanger dans la même seringue cette solution d’atracurium au thiopental ou à tout autre produit alcalin.
En cas d’injection dans une veine de petit calibre ou d’administration d’un autre anesthésique au travers de la même aiguille ou canule, un rinçage de cette aiguille ou canule par du sérum physiologique ou de l’eau pour préparations injectables est nécessaire.
CONTRE-INDICATIONS |
- Hypersensibilité à l’atracurium ou à l’acide benzène sulfonique.
- Hypersensibilité au cisatracurium.
MISES EN GARDE et PRÉCAUTIONS D’EMPLOI |
Mises en garde :
- L’atracurium ne doit être administré que par des anesthésistes ou des praticiens familiarisés avec l’utilisation et l’action des curares, ou sous leur contrôle. Du matériel d’intubation trachéale, d’assistance respiratoire et d’oxygénation artérielle adéquat doit être disponible.
- Comme avec tous les curares, la surveillance des fonctions neuromusculaires lors de l’utilisation de l’atracurium est recommandée afin d’ajuster individuellement les besoins.
- Réactions anaphylactiques :
Des réactions anaphylactiques aux curares en général ont été décrites (parfois sévères, telles que choc, arrêt cardiaque). Bien que ces phénomènes ne se produisent que très rarement avec l’atracurium, des précautions doivent toujours être prises pour pallier la survenue éventuelle de ces réactions (cf Effets indésirables). - Il convient de prendre des précautions particulières dans les cas d’antécédents connus de réactions anaphylactiques aux curares, une réactivité allergique croisée pouvant se produire avec ces agents.
- L’administration d’atracurium peut s’accompagner d’une libération d’histamine.
- Lors de l’administration d’atracurium, une attention particulière sera portée aux patients qui ont des antécédents d’hypersensibilité à d’autres curares, car un taux élevé de réactions allergiques croisées (supérieur à 50 %) entre les curares a été rapporté.
- Aux doses recommandées, l’atracurium n’a pas de propriétés vagolytiques ou ganglioplégiques significatives. Par conséquent, l’atracurium n’a aucun effet clinique significatif sur la fréquence cardiaque, aux doses recommandées, et ne neutralise pas la bradycardie induite par de nombreux agents anesthésiques ou par la stimulation vagale au cours des interventions.
- Comme avec les autres curares non dépolarisants, l’atracurium doit être utilisé avec précaution chez les patients souffrant de myasthénie ou d’autres maladies neuromusculaires, d’anomalies électrolytiques (hypokaliémie, hypocalcémie…).
- Les patients souffrant d’insuffisance cardiovasculaire peuvent être plus sensibles à une éventuelle hypotension induite par l’atracurium. Chez ces patients, l’injection sera lente, en plus de 60 secondes, et la dose fractionnée.
- La prudence est également recommandée chez les sujets atopiques et asthmatiques.
- L’atracurium est une solution hypotonique qui ne doit pas être perfusée dans la même tubulure qu’une transfusion sanguine.
- Les études réalisées chez l’animal ont montré que l’atracurium n’était pas un facteur déclenchant de l’hyperthermie maligne.
- Comme pour tous les curares non dépolarisants, une moindre efficacité peut apparaître chez les brûlés. En cas d’utilisation chez ce type de patients, une augmentation de posologie pourra être nécessaire en fonction de l’étendue et du temps écoulé depuis la survenue de la brûlure.
- Patients en unité de soins intensifs (USI) :
L’administration de laudanosine, métabolite de l’atracurium, et du cisatracurium à fortes doses chez des animaux de laboratoire a été accompagnée d’hypotension transitoire et, chez quelques espèces, d’effets à types d’excitation cérébrale. Chez les espèces animales les plus sensibles, ces effets sont survenus pour des concentrations plasmatiques en laudanosine identiques à celles observées chez des patients en USI après perfusion prolongée d’atracurium. - Il a été rapporté de rares cas de convulsions chez des patients en unités de soins intensifs qui avaient reçu, entre autres, de l’atracurium. Ces patients présentaient, en général, un ou plusieurs facteur(s) prédisposant aux convulsions (par exemple : traumatisme crânien, encéphalopathie hypoxique, oedème cérébral, encéphalite virale, urémie). Une relation de cause à effet n’a pu être établie (cf Effets indésirables).
INTERACTIONS |
Certaines substances peuvent modifier l’intensité et/ou la durée de l’effet des curares non dépolarisants.
- les anesthésiques volatils halogénés tels que isoflurane, enflurane, desflurane, sévoflurane ou halothane,
- les anesthésiques locaux,
- certains antibiotiques (aminosides, polymyxines, lincosanides, tétracyclines),
- le sulfate de magnésium (IV),
- les antagonistes du calcium,
- le dantrolène,
- les médicaments aggravant ou révélant une myasthénie latente, voire déclenchant un syndrome myasthénique, comme la quinidine, le lithium, le propranolol, les corticoïdes injectables, la télithromycine.
- la phénytoïne ou la carbamazépine, en administration chronique.
- Aminosides, colistine, lincosanides, polymyxine B : potentialisation des curares lorsque l’antibiotique est administré par voie parentérale et/ou péritonéale avant, pendant ou après l’agent curarisant. Surveiller le degré de curarisation en fin d’anesthésie.
A prendre en compte :
- Glucocorticoïdes (sauf hydrocortisone en traitement substitutif) : avec les glucocorticoïdes par voie IV, risque de myopathie sévère, réversible après un délai éventuellement long (plusieurs mois).
GROSSESSE et ALLAITEMENT |
L’atracurium traverse le placenta, mais aucun effet foetotoxique ou néonatal n’est apparu à ce jour. Les études chez l’animal n’ont pas mis en évidence d’effet sur la toxicité de la reproduction. Comme pour tous les curares, l’atracurium doit être évité pendant le premier trimestre de la grossesse et il ne doit pas être utilisé au cours des deuxième et troisième trimestres de la grossesse, sauf en cas de nécessité absolue.
Le bésilate d’atracurium peut être utilisé pour maintenir le relâchement musculaire au cours d’une césarienne puisqu’aux doses recommandées il ne traverse le placenta qu’en faibles quantités. Dans une étude ouverte, le bésilate d’atracurium (0,3 mg/kg) a été administré à 26 femmes enceintes au cours d’une césarienne. Bien que de faibles quantités de ce médicament aient traversé le placenta, aucun effet nocif imputable à l’atracurium n’a été observé chez le nouveau-né. La possibilité d’une dépression respiratoire chez le nouveau-né doit toujours être envisagée après une césarienne au cours de laquelle un agent bloquant neuromusculaire a été administré.
L’anesthésie au cours du troisième trimestre de la grossesse expose au syndrome de Mendelson (pneumopathie acide par inhalation de suc gastrique). Si un relaxant musculaire est utilisé pour l’induction de l’anesthésie, celui-ci doit être un curare à délai d’action bref et de durée d’action courte, ayant un passage transplacentaire faible, et il doit être utilisé à la dose la plus faible possible pour produire une relaxation musculaire optimale.
Allaitement :
L’atracurium a un poids moléculaire relativement élevé et il est fortement ionisé à pH physiologique ; ces deux facteurs réduisent considérablement le passage dans le lait maternel. Par ailleurs, bien que l’acidité du lait soit légèrement supérieure à celle du plasma, l’atracurium passé dans le lait devrait être rapidement métabolisé. Néanmoins, il est recommandé de suspendre l’allaitement pendant 24 heures après l’administration d’atracurium.
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
- Données des essais cliniques :
- Les événements mis en relation avec la libération d’histamine sont indiqués par une *.
- Affections vasculaires :
- Fréquent : hypotension (légère, passagère)*, rougeurs cutanées*.
- Fréquent : hypotension (légère, passagère)*, rougeurs cutanées*.
- Affections respiratoires, thoraciques et médiastinales :
- Peu fréquent : bronchospasme*.
- Peu fréquent : bronchospasme*.
- Données post-commercialisation :
- Affections du système immunitaire :
- Très rare : réactions anaphylactiques, réactions anaphylactoïdes.
- Très rarement, des réactions anaphylactoïdes ou anaphylactiques sévères telles que choc ou arrêt cardiaque ont été rapportées chez des patients recevant de l’atracurium en association avec un ou plusieurs agents anesthésiques. Des précautions doivent toujours être prises pour pallier la survenue éventuelle de ces réactions.
- Il convient de prendre des précautions particulières dans les cas d’antécédents connus de réactions anaphylactiques aux curares, une réactivité allergique croisée pouvant se produire avec ces agents (cf Mises en garde/Précautions d’emploi).
- Très rare : réactions anaphylactiques, réactions anaphylactoïdes.
- Affections du système nerveux :
- Fréquence inconnue : convulsions.
- Des cas de convulsions ont été observés chez des patients en unité de soins intensifs recevant de l’atracurium en association avec plusieurs autres agents. Ces patients présentaient habituellement une ou plusieurs prédispositions aux convulsions (ex : traumatisme crânien, oedème cérébral, encéphalite virale, encéphalopathie hypoxique, urémie). Cependant, aucune n’a été considérée comme attribuable à l’atracurium ou à la laudanosine, même après plusieurs semaines de perfusion. Lors des essais cliniques, aucune corrélation entre la concentration plasmatique de laudanosine et l’apparition de ces convulsions n’a été démontrée.
- Fréquence inconnue : convulsions.
- Affections musculosquelettiques et systémiques :
- Fréquence inconnue : myopathie, faiblesse musculaire.
- Des cas de faiblesse musculaire et/ou de myopathies ont été rapportés après perfusion prolongée de myorelaxants chez des patients sévères en unité de soins intensifs. La plupart des patients recevaient de manière concomitante des corticostéroïdes. De tels événements ont été rapportés en association avec l’atracurium et aucune relation de cause à effet n’a été établie.
- Fréquence inconnue : myopathie, faiblesse musculaire.
SURDOSAGE |
- Signes et symptômes :
- Les principaux signes de surdosage sont une paralysie musculaire prolongée et ses conséquences.
- Traitement :
- Il est essentiel de maintenir la ventilation pulmonaire artificielle jusqu’à l’obtention d’une respiration spontanée adéquate. La sédation totale est nécessaire, puisque la vigilance n’est pas modifiée par l’atracurium. La récupération peut être accélérée par l’administration d’anticholinestérasiques associés à l’atropine, dès l’observation des premiers signes de récupération spontanée.
PHARMACODYNAMIE |
Classe pharmacothérapeutique : curares (relaxant musculaire) ; code ATC : M03AC04 ; M : système locomoteur.
- L’atracurium est un agent bloquant neuromusculaire non dépolarisant. Son activité est intermédiaire entre celle des produits à longue durée et à courte durée d’action de cette classe pharmacologique. Il n’a pas d’action ganglioplégique, vagolytique, cardiovasculaire. Il n’entraîne qu’une faible libération d’histamine. Le délai d’action de l’atracurium est de 2 minutes en moyenne. Sa durée d’action varie de 15 à 35 minutes, en fonction des doses utilisées.
- Après administration des doses paralysantes, une myorelaxation suffisante est obtenue, permettant tous les types d’interventions chirurgicales (y compris la chirurgie pédiatrique, obstétricale et gériatrique). L’atracurium procure de bonnes conditions d’intubation.
- Dans les conditions usuelles d’anesthésie, l’atracurium, en raison de son élimination particulière et rapide, ne s’accumule pas et plusieurs doses d’entretien peuvent donc être successivement administrées. Il est donc utilisable au cours d’interventions chirurgicales de longue durée.
- Cette élimination, indépendante des fonctions rénale et hépatique, autorise l’utilisation de l’atracurium chez les insuffisants rénaux et/ou hépatiques.
- Le passage de l’atracurium au travers de la barrière placentaire est insignifiant, ce qui permet son utilisation au cours des césariennes.
PHARMACOCINÉTIQUE |
- Après injection IV d’une dose curarisante, l’atracurium diffuse rapidement. Dans le plasma, il se dégrade spontanément et rapidement grâce à deux facteurs : une réaction chimique spontanée au pH sanguin (réaction de dégradation d’Hofmann) et une hydrolyse ester, indépendante des pseudocholinestérases. Les métabolites ainsi formés sont pharmacologiquement inactifs aux doses usuelles d’atracurium.
- Chez les patients en unité de soins intensifs (USI), les concentrations en métabolites sont plus élevées chez les patients ayant des anomalies des fonctions rénale ou hépatique (cf Mises en garde/Précautions d’emploi). Ces métabolites n’ont pas d’activité curarisante.
- La demi-vie d’élimination est environ de 20 minutes, et le volume de distribution est de 0,16 l/kg. L’atracurium est lié à 82 % aux protéines plasmatiques.
- L’élimination de l’atracurium est indépendante de l’état des fonctions rénale et hépatique du malade.
- L’hémofiltration et l’hémodiafiltration ont un effet minime sur les taux plasmatiques de l’atracurium et de ses métabolites, y compris la laudanosine. Les effets de l’hémodialyse et de l’hémofiltration sur les taux plasmatiques de l’atracurium et de ses métabolites ne sont pas connus.
- La clairance de l’atracurium est d’environ 5 ml/min/kg.
- L’atracurium a une fixation protéique comparable à celle des autres curares qui ne présentent pas de problème d’interaction médicamenteuse à ce niveau. Le passage placentaire de l’atracurium est variable (les rapports foetomaternels varient entre 0,02 et 0,33).
SÉCURITE PRÉCLINIQUE |
L’atracurium a été évalué sur trois tests de génotoxicité in vitro et in vivo. Il s’est montré faiblement mutagène sur un seul test in vitro, sur culture de cellules de lymphomes de souris (MLA test), à des doses très élevées, cytotoxiques, quand des enzymes métabolisantes sont ajoutées.
INCOMPATIBILITÉS |
Ce médicament ne doit pas être mélangé avec d’autres médicaments, à l’exception de ceux mentionnés dans la rubrique Posologie/Mode d’administration.
MODALITÉS DE CONSERVATION |
- Durée de conservation :
- 2 ans.
Ampoules et flacon : à conserver au réfrigérateur (entre + 2 °C et + 8 °C), à l’abri de la lumière. Ne pas congeler.
Flacon : à conserver dans l’emballage extérieur.
Les ampoules ou les flacons ouverts et partiellement utilisés doivent être jetés.
MODALITÉS MANIPULATION/ÉLIMINATION |
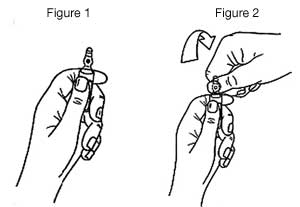
- Maintenir avec la main la partie inférieure de l’ampoule, comme indiqué sur la figure 1.
- Saisir la partie supérieure de l’ampoule avec l’autre main, le pouce posé sur le point coloré et exercer une pression, comme indiqué sur la figure 2.
 |
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| Réservé à l’usage hospitalier. | |
| AMM | 3400956511792 (1986, RCP rév 19.03.2010) 5 amp 25 mg/2,5 ml. |
| 3400956511853 (1986, RCP rév 18.03.2010) 5 amp 50 mg/5 ml. | |
| 3400956539369 (1994, RCP rév 18.03.2010) 1 fl 250 mg/25 ml. | |
| Collect. |
Laboratoire GlaxoSmithKline
100, route de Versailles. 78163 Marly-le-Roi cdx
Tél : 01 39 17 80 00
Info médic :
Tél : 01 39 17 84 44. Fax : 01 39 17 84 45
Pharmacovigilance : Tél : 01 39 17 80 16
Liste Des Sections Les Plus Importantes :
- pathologies
- Medicaments
- Medicaments injectables
- Traitement D’Urgence
- Guide Infirmier Des Examens De Laboratoire
- Infirmiers En Urgences
- Fiche Technique Medical
- Techniques De Manipulations En Radiologie Medicale
- Bibliotheque_medicale



