évérolimus
FORMES et PRÉSENTATIONS |
COMPOSITION |
| p cp | |
| Évérolimus (DCI) | 5 mg |
| ou | 10 mg |
Teneur en lactose : 149 mg/cp 5 mg ; 297 mg/cp 10 mg.
INDICATIONS |
POSOLOGIE ET MODE D’ADMINISTRATION |
La dose recommandée d’évérolimus est de 10 mg une fois par jour. Le traitement doit être poursuivi aussi longtemps qu’un bénéfice clinique est observé ou jusqu’à la survenue d’une toxicité inacceptable.
- Ajustement de la posologie en cas d’effets indésirables :
- La prise en charge d’événements indésirables graves et/ou indésirables mal tolérés, suspectés d’être reliés au traitement, peut nécessiter une modification de dose. Ce peut être une réduction et/ou une interruption temporaire (par exemple pendant une semaine) suivie d’une reprise du traitement à la dose de 5 mg. S’il est nécessaire de diminuer la posologie, la dose recommandée est de 5 mg par jour (cf Mises en garde et Précautions d’emploi).
- Populations particulières :
-
- Population pédiatrique : la sécurité et l’efficacité d’Afinitor chez les enfants âgés de 0 à 18 ans n’ont pas encore été établies. Aucune donnée n’est disponible.
- Patient âgé (>= 65 ans) : aucune adaptation de la posologie n’est nécessaire (cf Pharmacocinétique).
- Insuffisance rénale : aucune adaptation de la posologie n’est nécessaire (cf Pharmacocinétique).
- Insuffisance hépatique : chez les patients présentant une insuffisance hépatique modérée (classe B de Child-Pugh), la posologie doit être réduite à 5 mg par jour. L’évérolimus n’a pas été évalué chez les patients atteints d’insuffisance hépatique sévère (classe C de Child-Pugh) et son utilisation n’est pas recommandée dans cette population (cf Mises en garde et Précautions d’emploi, Pharmacocinétique).
- Population pédiatrique : la sécurité et l’efficacité d’Afinitor chez les enfants âgés de 0 à 18 ans n’ont pas encore été établies. Aucune donnée n’est disponible.
Mode d’administration :
Afinitor doit être pris par voie orale une fois par jour à la même heure chaque jour, avec ou sans aliments, de façon constante (cf Pharmacocinétique). Les comprimés d’Afinitor doivent être avalés entiers avec un verre d’eau. Les comprimés ne doivent pas être mâchés ou écrasés.
Si une dose est oubliée, le patient ne doit pas prendre une dose supplémentaire, mais prendre la prochaine dose normale prescrite.
CONTRE-INDICATIONS |
MISES EN GARDE et PRÉCAUTIONS D’EMPLOI |
- Pneumopathie non infectieuse :
- La pneumopathie non infectieuse est un effet de classe des dérivés de la rapamycine, y compris Afinitor. Des pneumopathies non infectieuses (y compris maladie pulmonaire interstitielle) ont été décrites chez 12 % des patients traités par Afinitor (cf Effets indésirables). Certains cas ont été sévères et, en de rares occasions, une issue fatale a été observée. Le diagnostic de pneumopathie non infectieuse doit être envisagé chez les patients présentant des signes et symptômes respiratoires non spécifiques tels qu’hypoxie, épanchement pleural, toux ou dyspnée et lorsqu’une étiologie infectieuse, néoplasique ou toutes autres causes non médicamenteuses ont été exclues par les investigations appropriées. Il convient de recommander aux patients de signaler sans attendre tout symptôme respiratoire nouveau ou qui s’aggrave.
- Chez les patients qui développent des modifications radiologiques évoquant une pneumopathie non infectieuse sans symptôme ou accompagnées de symptômes mineurs, le traitement par Afinitor peut être poursuivi sans modification de la posologie. En présence d’une symptomatologie modérée, l’interruption du traitement doit être envisagée jusqu’à l’amélioration des symptômes. L’administration de corticoïdes peut être indiquée. Afinitor pourra être introduit de nouveau à la dose de 5 mg par jour.
- Chez les patients présentant des symptômes sévères de pneumopathie non infectieuse, le traitement par Afinitor doit être arrêté et l’administration de corticoïdes peut être indiquée jusqu’à la résolution des symptômes cliniques. Le traitement par Afinitor pourra être introduit de nouveau en diminuant la posologie à 5 mg par jour en fonction des circonstances cliniques individuelles.
- Infections :
- Afinitor possède des propriétés immunosuppressives et il peut prédisposer les patients aux infections bactériennes, fongiques, virales ou parasitaires, comprenant les infections par des agents pathogènes opportunistes (cf Effets indésirables). Des infections localisées et systémiques, incluant des pneumonies, d’autres infections bactériennes, des infections fongiques invasives telles qu’aspergillose ou candidose, et les infections virales notamment des cas de réactivation d’hépatite virale B, ont été décrites chez des patients traités par Afinitor. Certaines de ces infections ont été sévères (conduisant, par exemple, à une insuffisance respiratoire ou hépatique) et parfois d’issue fatale.
- Les médecins et les patients doivent être conscients du risque accru d’infection avec Afinitor. Les infections préexistantes doivent être traitées de manière appropriée et la guérison complète doit être obtenue avant l’instauration d’un traitement par Afinitor. Au cours d’un traitement par Afinitor, il convient d’être vigilant aux signes et symptômes d’infection : si une infection est diagnostiquée, un traitement approprié doit être instauré dans les plus brefs délais et l’arrêt temporaire ou définitif d’Afinitor doit être envisagé.
- Si le diagnostic d’une infection fongique systémique invasive est fait, le traitement par Afinitor doit être arrêté immédiatement et définitivement, et le patient doit être traité par un traitement antifongique approprié.
- Réactions d’hypersensibilité :
- Des réactions d’hypersensibilité, manifestées par les symptômes comprenant, de façon non exhaustive, anaphylaxie, dyspnée, érythème, douleur thoracique et oedème de Quincke (par exemple gonflement des voies respiratoires et de la langue avec ou sans altération de la respiration), ont été observées avec l’évérolimus : cf Contre-indications.
- Ulcérations buccales :
- Des aphtes, une stomatite et une mucite buccale ont été observés chez des patients traités par Afinitor (cf Effets indésirables). Dans ce cas, des traitements topiques sont recommandés, mais les bains de bouche à base d’alcool ou d’eau oxygénée doivent être évités car ils peuvent exacerber l’affection. Les agents antifongiques ne doivent pas être utilisés, sauf si une infection fongique a été diagnostiquée (cf Interactions).
- Analyses biologiques et surveillance :
-
- Fonction rénale : des augmentations de la créatininémie, généralement légères, ont été rapportées dans les études cliniques (cf Effets indésirables). Il est recommandé de surveiller la fonction rénale, notamment l’urémie ou la créatininémie avant le début du traitement par Afinitor et régulièrement ensuite.
- Glycémie et lipides : des cas d’hyperglycémie, d’hyperlipidémie et d’hypertriglycéridémie ont été rapportés dans les études cliniques (cf Effets indésirables). La glycémie à jeun doit être contrôlée avant le début du traitement par Afinitor et régulièrement ensuite. Dans la mesure du possible, la glycémie doit être équilibrée de façon optimale avant l’instauration du traitement par Afinitor.
- Paramètres hématologiques : des diminutions de l’hémoglobine, des lymphocytes, des neutrophiles et des plaquettes ont été observées dans les études cliniques (cf Effets indésirables). La numération formule sanguine doit être contrôlée avant l’instauration du traitement par Afinitor et régulièrement ensuite.
- Fonction rénale : des augmentations de la créatininémie, généralement légères, ont été rapportées dans les études cliniques (cf Effets indésirables). Il est recommandé de surveiller la fonction rénale, notamment l’urémie ou la créatininémie avant le début du traitement par Afinitor et régulièrement ensuite.
- Interactions :
- L’administration concomitante avec des inhibiteurs et des inducteurs du CYP3A4 ou de la glycoprotéine P (PgP), pompe à efflux de nombreux médicaments, doit être évitée (cf Interactions). Si l’administration concomitante avec un inhibiteur ou un inducteur modéré du CYP3A4 et/ou de la PgP ne peut être évitée, des ajustements de dose peuvent être envisagés, basés sur l’AUC prévisible (cf Interactions).
- Le traitement concomitant avec des inhibiteurs puissants du CYP3A4 entraîne, de façon considérable, une augmentation de la concentration plasmatique de l’évérolimus (cf Interactions). Il n’y a pas actuellement de données suffisantes pour permettre une recommandation des doses dans cette situation. Ainsi, le traitement concomitant par Afinitor avec des inhibiteurs puissants n’est pas recommandé.
- Insuffisance hépatique :
- L’administration d’Afinitor n’est pas recommandée chez les patients présentant une insuffisance hépatique sévère (classe C de Child-Pugh) : cf Posologie et Mode d’administration, Pharmacocinétique.
- Vaccinations :
- L’utilisation de vaccins vivants doit être évitée au cours du traitement par Afinitor (cf Interactions).
- Lactose :
- Les patients présentant une intolérance au galactose, un déficit en lactase de Lapp ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne doivent pas prendre ce médicament.
- Complications de la cicatrisation des plaies :
- Une altération de la cicatrisation des plaies est un effet de la classe des dérivés de la rapamycine, y compris Afinitor. La prudence est donc requise avec l’utilisation d’Afinitor dans la phase périopératoire.
INTERACTIONS |
- Inhibiteurs du CYP3A4 et de la PgP susceptibles d’augmenter les concentrations d’évérolimus :
- Les inhibiteurs du CYP3A4 ou de la PgP peuvent augmenter les concentrations sanguines de l’évérolimus en diminuant le métabolisme ou l’efflux de l’évérolimus des cellules intestinales.
- Inducteurs du CYP3A4 et de la PgP susceptibles de diminuer les concentrations d’évérolimus :
- Les substances qui sont des inducteurs du CYP3A4 et de la PgP peuvent diminuer les concentrations sanguines de l’évérolimus en augmentant le métabolisme de l’évérolimus ou l’efflux de l’évérolimus des cellules intestinales.
| Substances actives par interaction | Interaction – Modifications de AUC/Cmax de l’évérolimus. Moyenne géométrique du rapport (intervalle des valeurs observées) | Recommandations pour l’administration concomitante |
| Inhibiteurs puissants de CYP3A4/PgP | ||
| Kétoconazole | AUC ^ 15,3 fois (intervalle 11,2-22,5) Cmax ^ 4,1 fois (intervalle 2,6-7,0) | L’administration concomitante d’Afinitor avec des inhibiteurs puissants n’est pas recommandée |
| Itraconazole, posaconazole, voriconazole | Non étudiée, une augmentation importante des concentrations de l’évérolimus est attendue | |
| Télithromycine, clarithromycine | ||
| Néfazodone | ||
| Ritonavir, atazanavir, saquinavir, darunavir, indinavir, nelfinavir | ||
| Inhibiteurs modérés de CYP3A4/PgP | ||
| Érythromycine | AUC ^ 4,4 fois (intervalle 2,0-12,6) Cmax ^ 2,0 fois (intervalle 0,9-3,5) | Utilisation avec précaution quand l’administration concomitante avec des inhibiteurs modérés du CYP3A4 ou de la PgP ne peut être évitée. |
| Vérapamil | AUC ^ 3,5 fois (intervalle 2,2-6,3) Cmax ^ 2,3 fois (intervalle 1,3-3,8) | |
| Ciclosporine orale | AUC ^ 2,7 fois (intervalle 1,5-4,7) Cmax ^ 1,8 fois (intervalle 1,3-2,6) | |
| Fluconazole | Non étudiée. Exposition accrue attendue | |
| Diltiazem | ||
| Amprénavir, fosamprénavir | Non étudiée. Exposition accrue attendue | |
| Jus de pamplemousse ou autres aliments ayant un effet sur les CYP3A4/PgP | Non étudiée. Exposition accrue attendue (variation élevée des effets) | L’association doit être évitée |
| Inducteurs puissants de CYP3A4/PgP | ||
| Rifampicine | AUC V 63 % (intervalle 0-80 %) Cmax V 58 % (intervalle 10-80 %) | Éviter l’utilisation concomitante avec les inducteurs puissants du CYP3A4. Si une administration concomitante avec un inducteur puissant du CYP3A4 est requise, une augmentation de la dose d’Afinitor de 10 mg par jour jusqu’à 20 mg par jour en utilisant une augmentation par pallier de 5 mg est appliquée le 4e jour et 8e jour après l’initiation du traitement par l’inducteur. Cette dose d’Afinitor est établie pour ajuster l’AUC à l’intervalle de valeurs observées sans inducteur. Toutefois, il n’existe aucune donnée clinique disponible avec cet ajustement de dose. Lorsque le traitement par l’inducteur puissant est arrêté, la dose d’Afinitor doit de nouveau être la dose utilisée avant l’instauration de l’administration concomitante. |
| Corticostéroïdes (par exemple dexaméthasone, prednisone, prednisolone) | Non étudiée. Diminution de l’exposition attendue | |
| Carbamazépine, phénobarbital, phénytoïne | Non étudiée. Diminution de l’exposition attendue | |
| Efavirenz, névirapine | Non étudiée. Diminution de l’exposition attendue | |
| Millepertuis (Hypericum perforatum) | Non étudiée. Diminution importante de l’exposition attendue | Les préparations contenant du millepertuis ne doivent pas être utilisées pendant un traitement par Afinitor. |
- Produits dont la concentration plasmatique peut être altérée par l’évérolimus :
- En fonction des résultats des études in vitro, au vu des concentrations systémiques obtenues avec des doses par voie orale de 10 mg, l’inhibition de la PgP, du CYP3A4 et du CYP2D6 est peu vraisemblable. Toutefois, l’inhibition du CYP3A4 et de la PgP dans l’intestin ne peut être exclue ; donc l’évérolimus peut modifier la biodisponibilité de substances (substrats du CYP3A4 et/ou de la PgP) administrées en association.
- Vaccinations :
- La réponse immunitaire à la vaccination peut être affectée. Ainsi, la vaccination au cours d’un traitement par Afinitor peut-elle être moins efficace. L’utilisation de vaccins vivants doit être évitée pendant le traitement par Afinitor (cf Mises en garde et Précautions d’emploi). Exemples de vaccins vivants : vaccin antigrippal intranasal, vaccins antirougeoleux, contre les oreillons, antirubéolique, vaccin antipoliomyélitique oral, BCG (bacillus Calmette-Guérin), vaccins antiamarile, contre la varicelle et vaccin typhoïde Ty21a.
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Il n’existe pas de données suffisamment pertinentes concernant l’utilisation d’Afinitor chez la femme enceinte. Des études effectuées chez l’animal ont mis en évidence une toxicité sur la reproduction (cf Sécurité préclinique).
L’évérolimus n’est pas recommandé chez la femme enceinte et chez la femme apte à procréer sans méthode contraceptive.
Fécondité :
Les observations précliniques indiquent que le traitement par Afinitor peut diminuer la fertilité masculine (cf Sécurité préclinique).
Femmes en âge d’avoir des enfants :
Les femmes en âge de procréer doivent utiliser une méthode contraceptive efficace pendant le traitement par l’évérolimus.
Allaitement :
On ne sait pas si l’évérolimus est excrété dans le lait maternel humain. Cependant, les études animales ont montré que l’évérolimus et/ou ses métabolites passaient facilement dans le lait. Par conséquent, les femmes traitées par évérolimus ne doivent pas allaiter.
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
- Très fréquent : infections(a).
- Très fréquent : diminution des lymphocytes(b), diminution de l’hémoglobine(b), diminution des plaquettes(b), diminution des neutrophiles(b).
- Fréquence indéterminée : hypersensibilité.
- Très fréquent : augmentation du glucose(b), augmentation du cholestérol(b), augmentation des triglycérides(b), diminution des phosphates(b), anorexie.
- Fréquent : déshydratation.
- Peu fréquent : apparition d’un diabète.
- Fréquent : insomnie.
- Très fréquent : dysgueusie.
- Fréquent : céphalées.
- Fréquent : conjonctivite, oedème de la paupière.
- Peu fréquent : insuffisance cardiaque congestive.
- Fréquent : hypertension.
- Fréquence indéterminée : hémorragie.
- Très fréquent : pneumopathie(c), dyspnée, épistaxis, toux.
- Fréquent : hémoptysie.
- Très fréquent : stomatite(d), diarrhée, mucite, vomissements, nausée.
- Fréquent : sécheresse buccale, douleur abdominale, dysphagie, dyspepsie.
- Très fréquent : augmentation de l’alanine aminotransférase(b), augmentation de l’aspartate aminotransférase(b).
- Fréquent : augmentation de la bilirubine(b).
- Très fréquent : rash, sécheresse cutanée, prurit.
- Fréquent : syndrome mains-pieds, érythème, exfoliation, altération des ongles, dermatite acnéiforme, ongles cassants.
- Peu fréquent : oedème de Quincke.
- Très fréquent : augmentation de la créatinine(b).
- Très fréquent : fatigue, asthénie, oedème périphérique.
- Fréquent : douleur thoracique, pyrexie.
- Peu fréquent : altération de la cicatrisation des plaies.
- Fréquent : perte de poids.
(a) Inclut tous les effets de la classe d’organe « Infections et infestations » (tels que pneumonie, sepsis et infections opportunistes [par exemple : aspergillose et candidose, cf Mises en garde et Précautions d’emploi]).
(b) Fréquence basée sur la détermination des valeurs biologiques anormales (comme une partie de l’évaluation biologique de routine).
(c) Inclut pneumopathie interstitielle pulmonaire, infiltration pulmonaire, hémorragie alvéolaire pulmonaire, toxicité pulmonaire et alvéolite.
(d) Inclut stomatite et aphtes, ulcération buccale et de la langue.
- Informations provenant de plusieurs études cliniques :
- Dans les essais cliniques, l’évérolimus a été associé à des cas sévères de réactivation d’hépatite B, notamment un cas d’issue fatale. La réactivation d’infections est un effet attendu pendant les phases d’immunosuppression.
SURDOSAGE |
PHARMACODYNAMIE |
Groupe pharmacothérapeutique : inhibiteurs de protéine kinase (code ATC : L01XE10).
- Mécanisme d’action :
- L’évérolimus est un inhibiteur sélectif de mTOR (Mammalian Target of Rapamycin-Cible de la rapamycine chez les mammifères). mTOR est une sérine-thréonine kinase dont l’activité est connue comme étant dérégulée dans de nombreux cas de cancers humains. L’évérolimus se lie à la protéine intracellulaire FKBP-12 formant un complexe qui inhibe l’activité du mTOR complex-1 (mTORC1). L’inhibition du mTORC1 dont la voie de signalisation interfère avec la traduction et la synthèse de protéines par réduction de l’activité de la protéine kinase ribosomale S6 (S6K1) et avec la protéine 4EBP-1 se liant au facteur d’élongation 4 (Eucaryotic Elongation Factor) qui régule les protéines impliquées dans le cycle cellulaire, l’angiogenèse et la glycolyse. L’évérolimus réduit les taux du facteur de croissance de l’endothélium vasculaire (VEGF) qui potentialise le processus d’angiogenèse tumoral. L’évérolimus est un inhibiteur puissant de la croissance et de la prolifération des cellules tumorales, des cellules endothéliales, des fibroblastes et des cellules musculaires lisses vasculaires et il a été montré qu’il réduisait la glycolyse des cellules tumorales in vitro et in vivo.
- Efficacité et sécurité clinique :
- Une étude de phase III multicentrique internationale randomisée en double aveugle a été menée comparant Afinitor 10 mg/jour au placebo, administrés tous les deux en association avec un traitement symptomatique optimal (BSC – Best Supportive Care) chez des patients ayant un cancer du rein métastatique dont la maladie avait progressé sous ou après un traitement par un VEGFR-TKI (inhibiteur de la tyrosine kinase du récepteur du facteur de croissance de l’endothélium vasculaire (sunitinib, sorafénib ou sunitinib plus sorafénib). Un traitement antérieur par le bévacizumab et l’interféron-alpha était également autorisé. Les patients ont été stratifiés en fonction du score pronostique du Memorial Sloan-Kettering Cancer Center (MSKCC) (groupes à risque faible versus intermédiaire versus élevé) et du traitement anticancéreux antérieur (1 versus 2 VEGFR-TKI).
- Le critère principal était la survie sans progression, documentée selon les critères RECIST (Response Evaluation Criteria in Solid Tumors) et évaluée en aveugle par un comité d’évaluation centralisé indépendant. Les critères secondaires étaient la sécurité d’emploi, le taux de réponse tumorale objective, la survie globale, les symptômes liés à la maladie et la qualité de vie. Après documentation d’une progression radiologique, l’aveugle pouvait être levé par l’investigateur : les patients randomisés dans le groupe placebo ont pu alors recevoir Afinitor 10 mg/jour en ouvert. Le comité indépendant de surveillance a recommandé d’arrêter cette étude au moment de la deuxième analyse intermédiaire car le critère principal avait été atteint.
- Au total, 416 patients ont été randomisés selon un rapport 2:1 pour recevoir Afinitor (n = 277) ou le placebo (n = 139). Les caractéristiques démographiques étaient équilibrées (âge médian 61 ans ; [intervalle 27-85 ans], hommes 78 %, Caucasiens 88 %, nombre de traitements antérieurs par un VEGFR-TKI [1 -74 %, 2 -26 %]). Afinitor était supérieur au placebo sur le critère principal de survie sans progression, avec une réduction statistiquement significative de 67 % du risque de progression ou décès (voir tableau 2 et figure 1).
-
Tableau 2 : Résultats en termes de survie sans progression Population n Afinitor n = 277 Placebo n = 139 Hazard ratio (IC à 95 %) Valeur P(a) Médiane de survie sans progression en mois (IC à 95 %) Analyse principale Tous patients (évaluation centrale indépendante en aveugle) 416 4,9 (4,0-5,5) 1,9 (1,8-1,9) 0,33 (0,25-0,43) < 0,0001(a) Analyses de confirmation/de sensibilité Tous patients (évaluation locale par l’investigateur) 416 5,5 (4,6-5,8) 1,9 (1,8-2,2) 0,32 (0,25-0,41) < 0,0001(a) Score pronostique MSKCC (revue centralisée indépendante en aveugle) Faible risque 120 5,8 (4,0-7,4) 1,9 (1,9-2,8) 0,31 (0,19-0,50) < 0,0001 Risque intermédiaire 235 4,5 (3,8-5,5) 1,8 (1,8-1,9) 0,32 (0,22-0,44) < 0,0001 Haut risque 61 3,6 (1,9-4,6) 1,8 (1,8-3,6) 0,44 (0,22-0,85) 0,007 -
(a)
Test log-rank stratifié
- Figure 1 : Courbes de survie sans progression Kaplan-Meier :
-
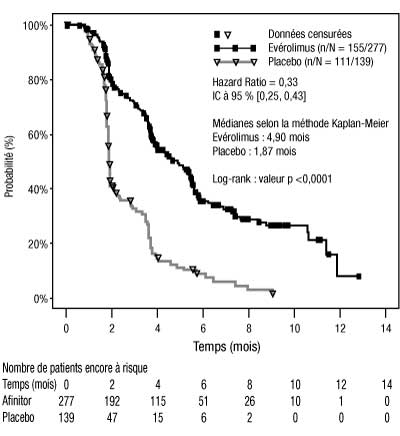
- Les taux de survie sans progression à 6 mois étaient de 36 % dans le groupe Afinitor comparé à 9 % dans le groupe placebo.
- Des réponses tumorales objectives confirmées ont été observées chez 5 patients (2 %) traités par Afinitor et chez aucun patient recevant le placebo. Ainsi, le bénéfice en termes de survie sans progression concerne essentiellement la population présentant une stabilisation de la maladie (correspondant à 67 % du groupe de traitement par Afinitor).
- Aucune différence statistiquement significative entre les traitements n’a été observée sur la survie globale (Hazard ratio 0,87, intervalle de confiance [0,65-1,17] ; P = 0,177). Le traitement par Afinitor en ouvert après progression chez les patients qui avaient reçu préalablement du placebo (cross over) ne permettait pas la mise en évidence d’une différence pour le critère de survie globale entre les deux bras.
- Population pédiatrique :
- L’Agence européenne du médicament a accordé une dérogation à l’obligation de soumettre les résultats d’études réalisées avec Afinitor dans tous les sous-groupes de la population pédiatrique atteints de cancer du rein (cf Posologie et Mode d’administration : pour les informations concernant l’usage pédiatrique).
PHARMACOCINÉTIQUE |
- Absorption :
- Chez les patients ayant des tumeurs solides avancées, les concentrations maximales d’évérolimus sont atteintes à une durée médiane d’une heure après l’administration quotidienne d’une dose orale de 5 à 10 mg à jeun ou avec un repas léger sans matières grasses. La Cmax est proportionnelle à la dose entre 5 mg et 10 mg. L’évérolimus est un substrat et un inhibiteur modéré de la PgP.
- Effet des aliments :
- Chez les volontaires, l’exposition systémique avec Afinitor 10 mg (mesurée par l’ASC) est diminuée de 22 % et le pic plasmatique de la Cmax est diminué de 54 % lorsque le médicament est pris avec un repas riche en graisses. Avec un repas léger, l’ASC est diminuée de 32 % et la Cmax est diminuée de 42 %. Les aliments n’ont toutefois pas eu d’effet sur la concentration en fonction du temps au cours de la phase postabsorption.
- Distribution :
- Le rapport sang-plasma de l’évérolimus est dépendant de la concentration (de 17 % à 73 % sur l’intervalle de 5 à 5000 ng/ml). Environ 20 % de la concentration de l’évérolimus dans le sang total est retrouvée dans le compartiment plasmatique chez les patients cancéreux recevant Afinitor 10 mg par jour. La liaison aux protéines plasmatiques est d’environ 74 % chez les sujets sains et chez les patients présentant une insuffisance hépatique modérée. Chez les patients ayant des tumeurs solides à un stade avancé, le volume de distribution Vd était de 191 l dans le compartiment central apparent et de 517 l dans le compartiment périphérique apparent.
- Métabolisme :
- L’évérolimus est un substrat du CYP3A4 et de la PgP. Après administration orale, l’évérolimus est le composé principal circulant dans le sang chez l’homme. Six métabolites principaux de l’évérolimus ont été identifiés dans le sang chez l’homme, incluant trois métabolites monohydroxylés, deux produits à cycle ouvert formés par hydrolyse et un conjugué phosphatidylcholine de l’évérolimus. Ces métabolites ont également été identifiés chez les espèces animales utilisées dans les études de toxicité et ils ont présenté une activité 100 fois plus faible environ que celle de l’évérolimus lui-même. Par conséquent, l’évérolimus est considéré comme responsable de la majorité de l’activité pharmacologique globale.
- Élimination :
- La valeur moyenne de la clairance orale (CL/F) de l’évérolimus chez des patients ayant des tumeurs solides recevant 10 mg par jour était de 24,5 l/h. La valeur moyenne de la demi-vie d’élimination était approximativement de 30 heures.
- Il n’a pas été mené d’études d’excrétion spécifiques chez les patients cancéreux, mais des données sont disponibles chez les patients transplantés. Après administration d’une dose unique d’évérolimus radiomarqué en association avec la ciclosporine, 80 % de la radioactivité ont été retrouvés dans les fèces et 5 % ont été excrétés dans les urines. La molécule mère n’a pas été détectée dans les urines ou dans les fèces.
- Pharmacocinétique à l’état d’équilibre :
- Après l’administration d’évérolimus chez des patients ayant des tumeurs solides à un stade avancé, l’ASC00-tau a été dose-proportionnelle dans l’intervalle de dose quotidienne de 5 mg à 10 mg. L’état d’équilibre a été atteint en deux semaines. La Cmax est proportionnelle à la dose entre 5 mg et 10 mg. Le tmax est atteint 1 à 2 heures après l’administration. Il a été observé une corrélation significative entre l’ASC00-tau et la concentration résiduelle prédose à l’état d’équilibre.
- Populations particulières :
-
- Insuffisance hépatique : chez 8 sujets présentant une insuffisance hépatique modérée (classe B de Child-Pugh), l’ASC moyenne de l’évérolimus a été multipliée par 2 par rapport à celle observée chez 8 sujets ayant une fonction hépatique normale. L’ASC a été corrélée positivement avec la bilirubinémie et avec l’allongement du temps de prothrombine et négativement avec l’albuminémie. L’effet d’une insuffisance hépatique sévère (classe C de Child-Pugh) n’a pas été évalué (cf Posologie et Mode d’administration, Mises en garde et Précautions d’emploi).
- Insuffisance rénale : dans une analyse de pharmacocinétique de population chez 170 patients ayant des tumeurs solides à un stade avancé, aucun effet significatif de la clairance de la créatinine (25-178 ml/min) n’a été observé sur la clairance orale (Cl/F) de l’évérolimus. Une insuffisance rénale post-transplantation (clairance de la créatinine comprise entre 11 ml/min et 107 ml/min) n’a pas eu d’effet sur la pharmacocinétique de l’évérolimus chez des patients transplantés.
- Patients âgés : dans une analyse pharmacocinétique de population chez des patients cancéreux, aucun effet significatif de l’âge (27 à 85 ans) sur la clairance orale de l’évérolimus n’a été observé.
- Groupe ethnique : la clairance orale (Cl/F) est similaire chez les patients cancéreux japonais et caucasiens ayant une fonction hépatique comparable. Selon une analyse de pharmacocinétique de population, la clairance orale (Cl/F) est supérieure de 20 % en moyenne chez les patients transplantés de race noire.
- Insuffisance hépatique : chez 8 sujets présentant une insuffisance hépatique modérée (classe B de Child-Pugh), l’ASC moyenne de l’évérolimus a été multipliée par 2 par rapport à celle observée chez 8 sujets ayant une fonction hépatique normale. L’ASC a été corrélée positivement avec la bilirubinémie et avec l’allongement du temps de prothrombine et négativement avec l’albuminémie. L’effet d’une insuffisance hépatique sévère (classe C de Child-Pugh) n’a pas été évalué (cf Posologie et Mode d’administration, Mises en garde et Précautions d’emploi).
SÉCURITE PRÉCLINIQUE |
Le profil de sécurité préclinique de l’évérolimus a été évalué chez la souris, le rat, le cochon nain, le singe et le lapin. Les principaux organes cibles ont été les systèmes de reproduction mâle et femelle (dégénérescence tubulaire testiculaire, diminution de la quantité de sperme dans les épididymes et atrophie utérine) chez plusieurs espèces, les poumons (prolifération des macrophages alvéolaires) chez le rat et la souris ; le pancréas (dégranulation et apparition de vacuoles dans les cellules exocrines chez les singes et cochons nains, dégénération des cellules des ilôts de Langerhans chez les singes), et les yeux (opacités des fibres antérieures du cristallin) chez les rats seulement. Des modifications rénales mineures ont été observées chez le rat (exacerbation liée à l’âge de la lipofuscine dans l’épithélium tubulaire, augmentations de l’hydronéphrose) et la souris (aggravation de lésions préexistantes). Aucun signe de néphrotoxicité n’a été observé chez le singe et le cochon nain.
L’évérolimus a semblé exacerber spontanément des pathologies préexistantes (myocardite chronique chez le rat, infection du plasma et du coeur par le virus coxsackie chez le singe, infestation coccidienne du tractus gastro-intestinal chez le cochon nain, lésions cutanées chez la souris et le singe). Ces effets ont été généralement observés à des niveaux d’exposition systémique équivalents ou supérieurs aux niveaux d’exposition thérapeutique, à l’exception des effets observés chez le rat, qui se sont produits à des niveaux inférieurs à l’exposition thérapeutique en raison d’une distribution tissulaire élevée.
Au cours d’une étude de fertilité chez le rat mâle, la morphologie testiculaire a été affectée à des doses de 0,5 mg/kg et plus, et la motilité, le nombre de spermatozoïdes et le taux plasmatique de testostérone ont été diminués à la dose de 5 mg/kg, correspondant aux niveaux d’exposition thérapeutique, et qui a entraîné une diminution de la fertilité des mâles. Ces altérations ont été réversibles. La fertilité des femelles n’a pas été affectée, mais l’évérolimus a traversé la barrière placentaire et s’est avéré toxique pour le foetus. Chez le rat, l’évérolimus a provoqué une embryo/foetotoxicité se manifestant par une mortalité et une réduction du poids foetal à un niveau d’exposition systémique inférieur au niveau thérapeutique. L’incidence de modifications et de malformations du squelette (fente sternale par exemple) a été augmentée aux doses de 0,3 mg/kg et 0,9 mg/kg. Chez le lapin, l’embryotoxicité s’est manifestée par une augmentation des résorptions tardives.
Les études de génotoxicité évaluant les critères pertinents n’ont pas mis en évidence d’activité clastogène ou mutagène. L’administration d’évérolimus pendant des durées allant jusqu’à 2 ans n’a pas indiqué de potentiel oncogène chez la souris et le rat jusqu’aux doses les plus élevées, correspondant respectivement à 4,3 et 0,2 fois l’exposition clinique estimée.
MODALITÉS DE CONSERVATION |
- Durée de conservation :
- 3 ans.
A conserver dans l’emballage extérieur d’origine, à l’abri de la lumière et de l’humidité.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| Médicament soumis à prescription hospitalière. | |
| Prescription réservée aux spécialistes en oncologie ou en hématologie, ou aux médecins compétents en cancérologie. | |
| Médicament nécessitant une surveillance particulière pendant le traitement. | |
| AMM | EU/1/09/538/001 ; CIP 3400939628110 (RCP rév 28.03.2011) cp à 5 mg. |
| EU/1/09/538/004 ; CIP 3400939628288 (RCP rév 28.03.2011) cp à 10 mg. | |
| Prix : | 2893.74 euros (30 comprimés à 5 mg). |
| 4123.23 euros (30 comprimés à 10 mg). | |
| Remb Séc soc à 100 %. Collect. | |
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne du médicament : http://www.ema.europa.eu.
Titulaire de l’AMM : Novartis Europharm Ltd, Horsham, Royaume-Uni.
Novartis Pharma SAS
2-4, rue Lionel-Terray. 92500 Rueil-Malmaison
Tél : 01 55 47 60 00
Information et Communication Médicales :
Tél : 01 55 47 66 00 E-mail : icm.phfr@novartis.com
Site web : http://www.novartis.fr
Liste Des Sections Les Plus Importantes :
- pathologies
- Medicaments
- Medicaments injectables
- Traitement D’Urgence
- Guide Infirmier Des Examens De Laboratoire
- Infirmiers En Urgences
- Fiche Technique Medical
- Techniques De Manipulations En Radiologie Medicale
- Bibliotheque_medicale



