insuline asparte biphasique
FORMES et PRÉSENTATIONS |
NovoMix 30 Penfill :
Suspension injectable SC à 100 U/ml (blanche) : Cartouches* de 3 ml, boîte de 5. NovoMix 30 FlexPen :
Suspension injectable SC à 100 U/ml (blanche) : Cartouches* de 3 ml en stylo injecteur multidose prérempli jetable, boîte de 5.
NovoMix 50 FlexPen :
Suspension injectable SC à 100 U/ml (blanche) : Cartouches* de 3 ml en stylo injecteur multidose prérempli jetable, boîte de 5.
NovoMix 70 FlexPen :
Suspension injectable SC à 100 U/ml (blanche) : Cartouches* de 3 ml en stylo injecteur multidose prérempli jetable, boîte de 5. * La cartouche contient une bille de verre qui facilite la remise en suspension.
COMPOSITION |
| p cartouche ou p stylo | |
| Insuline asparte* (DCI) | 300 U |
1 ml de suspension contient 100 U (soit 3,5 mg) d’insuline asparte soluble/insuline asparte protamine cristallisée, dans un rapport de 30/70 (NovoMix 30), 50/50 (NovoMix 50) et 70/30 (NovoMix 70).
* Produite par la technique de l’ADN recombinant sur Saccharomyces cerevisiae.
INDICATIONS |
- NovoMix 30 :
- Traitement du diabète de l’adulte, de l’adolescent et de l’enfant de 10 à 17 ans.
- NovoMix 50 et NovoMix 70 :
- Traitement du diabète de l’adulte.
POSOLOGIE ET MODE D’ADMINISTRATION |
La teneur en insuline des analogues de l’insuline, y compris l’insuline asparte, est exprimée en unités (U), alors que la teneur en insuline de l’insuline humaine est exprimée en unités internationales (UI).
La posologie de NovoMix dépend de chaque individu et est déterminée en fonction des besoins du patient. Un contrôle glycémique et un ajustement de la posologie de l’insuline sont recommandés afin d’obtenir un équilibre glycémique optimal.
Un ajustement de la dose peut être nécessaire si le patient augmente son activité physique, modifie son régime alimentaire ou en cas de maladie concomitante.
Chez les patients diabétiques, un contrôle métabolique optimal retarde efficacement l’apparition des complications tardives du diabète et en ralentit la progression. Un contrôle métabolique optimal, incluant la surveillance glycémique, est donc recommandé.
- NovoMix 30 :
- Chez les patients diabétiques de type 2, NovoMix 30 peut être administré en monothérapie. NovoMix 30 peut être également administré en association à des antidiabétiques oraux si la glycémie des patients est insuffisamment contrôlée par des antidiabétiques oraux seuls. Pour les patients diabétiques de type 2, la dose initiale de NovoMix 30 recommandée est de 6 U au petit déjeuner et de 6 U au dîner (repas du soir). NovoMix 30 peut également être initié en une injection par jour de 12 U au dîner (repas du soir). Lorsque NovoMix 30 est utilisé en une injection par jour et que la dose atteint 30 unités, il est généralement recommandé de passer à deux injections par jour en répartissant à part égale la dose du petit déjeuner et la dose du dîner (repas du soir). Si des épisodes récurrents d’hypoglycémies apparaissent dans la journée avec deux injections par jour de NovoMix 30, la dose du matin pourra être répartie en une dose le matin et une dose à midi (soit 3 injections par jour).
- Il est conseillé de suivre les recommandations de titration suivantes pour l’adaptation des doses :
-
Glycémie préprandiale Adaptation de la dose de NovoMix 30 < 4,4 mmol/l < 80 mg/dl – 2 U 4,4 – 6,1 mmol/l 80 – 110 mg/dl 0 6,2 – 7,8 mmol/l 111 – 140 mg/dl + 2 U 7,9 – 10 mmol/l 141 – 180 mg/dl + 4 U > 10 mmol/l > 180 mg/dl + 6 U - La glycémie préprandiale la plus basse des trois derniers jours doit être prise en compte. La dose ne doit pas être augmentée s’il y a eu un épisode hypoglycémique lors de ces trois derniers jours. L’adaptation des doses peut être réalisée une fois par semaine jusqu’à ce que l’objectif d’HbA1c soit atteint. Les glycémies mesurées avant le repas doivent être utilisées pour adapter la dose précédente.
- L’association de NovoMix 30 avec la pioglitazone doit uniquement être envisagée après évaluation clinique du risque de survenue de signes ou symptômes d’effets indésirables liés à une rétention hydrique chez un patient traité. L’initiation de NovoMix 30 doit être effectuée avec précaution en augmentant la posologie jusqu’à la plus petite dose nécessaire pour atteindre le contrôle glycémique (cf Mises en garde et Précautions d’emploi).
- Chez les patients diabétiques de type 1, les besoins individuels en insuline se situent généralement entre 0,5 et 1 U/kg/jour. Ils peuvent être couverts en partie ou en totalité par NovoMix 30. Les besoins journaliers en insuline peuvent être plus élevés chez les patients présentant une résistance à l’insuline (due à l’obésité, par exemple) et plus faibles en cas d’insulinosécrétion endogène résiduelle.
-
- Populations particulières :
-
- Sujets âgés (>= 65 ans) :
NovoMix 30 peut être utilisé chez les sujets âgés ; cependant l’expérience de l’utilisation de NovoMix 30 en association avec les antidiabétiques oraux chez les patients de plus de 75 ans est limitée. - Comme pour toutes les insulines, il est nécessaire d’intensifier le contrôle glycémique et d’ajuster la dose de l’insuline asparte de façon individuelle chez les patients âgés.
- Sujets atteints de troubles rénaux ou hépatiques :
Les troubles rénaux ou hépatiques peuvent réduire les besoins du patient en insuline. - Comme pour toutes les insulines, il est nécessaire d’intensifier le contrôle glycémique et d’ajuster la dose de l’insuline asparte de façon individuelle chez les patients atteints de troubles rénaux ou hépatiques.
- Sujets âgés (>= 65 ans) :
-
- Population pédiatrique :
- NovoMix 30 peut être utilisé chez les enfants et les adolescents à partir de 10 ans lorsque l’insuline prémélangée est préférée. Il existe des données cliniques limitées chez les enfants de 6 à 9 ans (cf Pharmacodynamie).
- Aucune étude clinique n’a été réalisée avec NovoMix 30 chez l’enfant de moins de 6 ans. NovoMix 30 ne pourra être utilisé chez ces patients que sous contrôle médical attentif.
-
- En remplacement d’autres insulines :
- Le remplacement de l’insuline humaine biphasique par NovoMix 30 chez un patient devra débuter avec la même dose et le même schéma d’administration. Il faudra ensuite adapter la dose en fonction des besoins individuels (voir les recommandations de titration pour l’adaptation des doses dans le tableau ci-dessus).
- Comme pour toutes les insulines, il est recommandé de surveiller attentivement la glycémie lors du changement de traitement et durant les première semaines (cf Mises en garde et Précautions d’emploi).
- NovoMix 50 et NovoMix 70 :
- Les besoins individuels en insuline se situent généralement entre 0,5 et 1 U/kg/jour chez l’adulte et ils peuvent être couverts en partie ou en totalité par NovoMix 50 ou NovoMix 70. Les besoins journaliers en insuline peuvent être plus élevés chez les patients présentant une résistance à l’insuline (due à l’obésité, par exemple) et plus faibles en cas d’insulinosécrétion endogène résiduelle.
- Chez les patients diabétiques de type 2, NovoMix 50 ou NovoMix 70 peut être administré seul ou en association avec la metformine lorsque la glycémie est insuffisamment contrôlée par la metformine seule.
-
- Populations particulières :
- Comme pour toutes les insulines, il est nécessaire d’intensifier le contrôle glycémique et d’ajuster la dose de l’insuline asparte de façon individuelle chez les patients âgés (>= 65 ans) et chez les patients atteints de troubles rénaux ou hépatiques.
- Les troubles rénaux ou hépatiques peuvent réduire les besoins du patient en insuline.
-
- Population pédiatrique :
- Aucune étude clinique n’a été réalisée avec NovoMix 50 et NovoMix 70 chez l’enfant ou l’adolescent de moins de 18 ans.
- NovoMix 50 et NovoMix 70 ne pourront être utilisés chez ces patients que sous contrôle médical attentif.
-
- En remplacement d’autres insulines :
- Le remplacement d’une insuline par NovoMix 50 ou NovoMix 70 peut nécessiter une adaptation de la dose et des horaires d’administration. Comme pour toutes les insulines, il est recommandé de surveiller attentivement la glycémie lors du changement de traitement et durant les première semaines (cf Mises en garde et Précautions d’emploi).
Mode d’administration :
NovoMix doit être administré par voie sous-cutanée uniquement. NovoMix ne doit pas être administré par voie intraveineuse en raison du risque d’hypoglycémie sévère. L’administration intramusculaire doit être évitée. NovoMix ne doit pas être utilisé dans les pompes à perfusion d’insuline.
NovoMix doit être administré par voie sous-cutanée au niveau de la cuisse ou la paroi abdominale. Si besoin, la région fessière ou deltoïde peuvent être utilisées. Une rotation des sites d’injection au sein d’une même région devra toujours être effectuée. L’influence des différents sites d’injection sur l’absorption de NovoMix n’a pas été étudiée. Comme pour toutes les insulines, la durée d’action varie en fonction de la dose, du site d’injection, du débit sanguin, de la température et de l’intensité de l’activité physique.
NovoMix FlexPen est un stylo prérempli conçu pour être utilisé avec les aiguilles NovoFine ou NovoTwist. FlexPen permet d’injecter 1 à 60 unités par palier de 1 unité.
NovoMix FlexPen a un code couleur.
NovoMix Penfill est conçu pour être utilisé avec les systèmes d’administration d’insuline Novo Nordisk et les aiguilles NovoFine ou NovoTwist.
Il est nécessaire d’informer les patients qu’ils ne doivent pas utiliser d’aiguilles contrefaites.
NovoMix est accompagné d’une notice dont les instructions doivent être respectées.
- NovoMix 30 :
- NovoMix 30 présente un délai d’action plus rapide que l’insuline humaine biphasique et doit généralement être administré immédiatement avant un repas. Si nécessaire, NovoMix 30 peut être injecté peu après un repas.
- NovoMix 50 et NovoMix 70 :
- Le délai d’action rapide et le pic d’activité précoce de l’insuline asparte permettent à NovoMix 50 et NovoMix 70 d’être administrés immédiatement avant un repas. Si nécessaire, NovoMix 50 et NovoMix 70 peuvent être injectés peu après un repas.
CONTRE-INDICATIONS |
MISES EN GARDE et PRÉCAUTIONS D’EMPLOI |
- Hypoglycémie :
- L’omission d’un repas ou un exercice physique important non prévu peut entraîner une hypoglycémie.
- Une hypoglycémie peut survenir si la dose d’insuline est trop élevée pour les besoins du patient (cf Effets indésirables, Surdosage).
- Les patients dont le contrôle glycémique est nettement amélioré, par exemple dans le cadre d’une insulinothérapie intensifiée, peuvent constater un changement des signes précurseurs habituels d’hypoglycémie et doivent être avertis de cette éventualité. Les signes précurseurs habituels peuvent disparaître chez les patients présentant un diabète ancien.
- Comme NovoMix doit être administré immédiatement avant ou après un repas, il faudra tenir compte de son délai d’action rapide chez les patients atteints de maladies concomitantes ou prenant d’autres traitements et chez lesquels l’absorption de nourriture est susceptible d’être retardée.
- Les maladies concomitantes, en particulier les infections et les états fébriles, augmentent généralement les besoins en insuline du patient. Les maladies concomitantes au niveau des reins, du foie ou des glandes surrénales, hypophysaire ou thyroïde peuvent nécessiter un ajustement de la dose d’insuline.
- Si le patient change de type d’insuline, les symptômes précurseurs d’hypoglycémie peuvent être modifiés ou devenir moins prononcés que ceux survenus avec sa précédente insuline.
- En remplacement d’autres insulines :
- En cas de changement de type ou de marque d’insuline, le patient devra faire l’objet d’un suivi médical attentif. Les changements de concentration, de marque (fabricant), de type, d’origine (animale, humaine, analogue de l’insuline humaine) et/ou de méthode de fabrication (ADN recombinant ou insuline d’origine animale) peuvent nécessiter un changement de dose. Les patients qui passent à NovoMix en remplacement d’un autre type d’insuline pourront nécessiter une augmentation du nombre d’injections ou une modification de la dose par rapport à leurs insulines habituelles. Si un ajustement de la posologie s’avère nécessaire, il pourra être effectué dès la première injection ou pendant les premières semaines ou les premiers mois.
- Réactions au site d’injection :
- Comme avec toute insulinothérapie, des réactions au site d’injection peuvent survenir, se traduisant par une douleur, une rougeur, un urticaire, une inflammation, une tuméfaction et un prurit. Une rotation continue des sites d’injection dans une même région peut aider à diminuer ou éviter ces réactions. Ces réactions disparaissent généralement en l’espace de quelques jours à quelques semaines. Dans de rares cas, les réactions au site d’injection peuvent nécessiter l’arrêt de NovoMix.
- Association de NovoMix avec la pioglitazone :
- Des cas d’insuffisance cardiaque ont été rapportés lorsque la pioglitazone était utilisée en association avec de l’insuline, en particulier chez les patients présentant des facteurs de risque de survenue d’une insuffisance cardiaque. Ceci doit être pris en compte si un traitement associant la pioglitazone et NovoMix est envisagé. Si une telle association est instaurée, il sera nécessaire de surveiller, chez ces patients, la survenue de signes et de symptômes d’insuffisance cardiaque, de prise de poids et d’oedème. La pioglitazone devra être arrêtée si une aggravation des symptômes d’insuffisance cardiaque survient.
- NovoMix 30 :
-
- Hypoglycémie :
- Par rapport à l’insuline humaine biphasique, NovoMix 30 peut avoir un effet plus important sur la baisse du glucose dans les 6 heures suivant l’injection. Ceci devra être éventuellement compensé, en fonction des patients, par un ajustement de la dose d’insuline et/ou par une prise alimentaire.
- Un contrôle glycémique plus rigoureux peut augmenter le risque d’épisodes hypoglycémiques et nécessite donc une attention particulière lors de l’intensification de la posologie, comme décrit dans la rubrique Posologie/Mode d’administration.
INTERACTIONS |
Un certain nombre de médicaments sont connus pour interagir avec le métabolisme du glucose.
FERTILITÉ/GROSSESSE/ALLAITEMENT |
L’expérience clinique avec NovoMix pendant la grossesse est limitée.
Les études sur la reproduction animale n’ont pas mis en évidence de différence entre l’insuline asparte et l’insuline humaine en termes d’embryotoxicité ou d’effets tératogènes.
Chez la femme enceinte diabétique, il est généralement recommandé d’intensifier le contrôle glycémique et la surveillance tout au long de la grossesse ainsi qu’en cas de projet de grossesse. Les besoins en insuline chutent habituellement au cours du premier trimestre puis augmentent au cours des deuxième et troisième trimestres. Après l’accouchement, les besoins en insuline reviennent rapidement au niveau antérieur à la grossesse.
Allaitement :
L’administration de NovoMix pendant l’allaitement ne fait l’objet d’aucune restriction. L’insulinothérapie de la mère qui allaite ne présente aucun risque pour le bébé. Il peut cependant être nécessaire d’adapter la dose de NovoMix.
Fécondité :Les études de reproduction animale n’ont pas révélé de différences entre l’insuline asparte et l’insuline humaine sur la fécondité.
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
- Résumé du profil de tolérance :
- Les effets indésirables observés chez les patients traités par NovoMix sont le plus souvent dose-dépendants et sont dus à l’action pharmacologique de l’insuline.
- L’effet indésirable le plus fréquemment rapporté lors du traitement est l’hypoglycémie. La fréquence des hypoglycémies varie en fonction de la population de patients, des doses utilisées et du niveau du contrôle glycémique, voir le paragraphe Description de certains effets indésirables ci-après.
- Au début du traitement par insuline, des anomalies de la réfraction, des oedèmes et des réactions d’hypersensibilité locale (douleur, rougeur, urticaire, inflammation, tuméfaction et prurit au site d’injection) peuvent survenir ; ces réactions sont habituellement transitoires. Une amélioration rapide de l’équilibre glycémique peut être associée à une neuropathie douloureuse aiguë qui est habituellement réversible. Une intensification de l’insulinothérapie avec une amélioration soudaine de l’équilibre glycémique peut être associée à une aggravation transitoire de la rétinopathie diabétique, tandis que l’amélioration de l’équilibre glycémique à long terme diminue le risque de progression de la rétinopathie diabétique.
- Liste tabulée des effets indésirables :
- Les effets indésirables répertoriés ci-dessous sont issus des données des essais cliniques et classés par fréquence MedDRA et selon le système de classification par organe. Les catégories de fréquence sont définies selon les conventions suivantes : très fréquent (>= 1/10) ; fréquent (>= 1/100, < 1/10) ; peu fréquent (>= 1/1000, < 1/100) ; rare (>= 1/10 000, < 1/1000) ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimée à partir des données disponibles).
-
Affections du système immunitaire Peu fréquent : urticaire, rash, éruptions Très rare : réactions anaphylactiques* Troubles du métabolisme et de la nutrition Très fréquent : hypoglycémie* Affections du système nerveux Rare : neuropathie périphérique Affections oculaires Peu fréquent : anomalies de la réfraction, rétinopathie diabétique Affections de la peau et du tissu sous-cutané Peu fréquent : lipodystrophie*, hypersensibilité locale Troubles généraux et anomalies au site d’administration Peu fréquent : oedème -
*
Voir le paragraphe Description de certains effets indésirables ci-dessous.
- Description de certains effets indésirables :
-
- Hypoglycémie :
- L’effet indésirable le plus fréquemment rapporté est l’hypoglycémie. Celle-ci survient lorsque la dose d’insuline est trop importante par rapport aux besoins insuliniques. L’hypoglycémie sévère peut entraîner une perte de connaissance et/ou des convulsions et peut causer une altération transitoire ou définitive des fonctions cérébrales, voire le décès. Les symptômes de l’hypoglycémie surviennent habituellement de manière soudaine. Ils peuvent inclure : sueurs froides, pâleur et froideur cutanée, fatigue, nervosité ou tremblement, anxiété, asthénie ou faiblesse inhabituelles, confusion, difficulté de concentration, somnolence, sensation de faim excessive, troubles visuels, maux de tête, nausées et palpitations.
- Lors des essais cliniques, la fréquence des hypoglycémies a varié en fonction de la population de patients, des doses utilisées et du niveau du contrôle glycémique. Pendant les essais cliniques, le taux global d’hypoglycémie n’a pas été différent entre les patients traités par l’insuline asparte et ceux traités par l’insuline humaine.
-
- Réactions anaphylactiques :
- La survenue de réactions d’hypersensibilité généralisée (notamment des éruptions cutanées généralisées, démangeaisons, sueurs, troubles gastro-intestinaux, oedème angioneurotique, difficultés respiratoires, palpitations et baisse de la pression artérielle) est très rare mais ces réactions peuvent potentiellement menacer le pronostic vital.
-
- Lipodystrophie :
- La lipodystrophie est peu fréquente. Elle peut survenir au niveau du site d’injection ; il est donc conseillé d’alterner les sites d’injection au sein d’une même région.
- Population pédiatrique :
-
- NovoMix 30 :
- Depuis la mise sur le marché et lors des essais cliniques, la fréquence, le type et la sévérité des effets indésirables observés dans la population pédiatrique ne montrent pas de différences avec une plus grande expérience acquise dans la population générale.
-
- NovoMix 50 et NovoMix 70 :
- Aucune étude clinique n’a été réalisée avec NovoMix 50 et NovoMix 70 chez l’enfant ou l’adolescent de moins de 18 ans. NovoMix 50 et NovoMix 70 ne pourront être utilisés chez ces patients que sous contrôle médical attentif. Cf Posologie et Mode d’administration.
- Autres populations particulières :
- Depuis la mise sur le marché et lors des essais cliniques, la fréquence, le type et la sévérité des effets indésirables observés chez les patients âgés et chez les patients atteints de troubles rénaux ou hépatiques ne montrent pas de différences avec une plus grande expérience acquise dans la population générale.
SURDOSAGE |
- Les épisodes d’hypoglycémie modérée peuvent être traités par administration orale de glucose ou de produits sucrés. On conseille donc aux patients diabétiques d’avoir toujours sur eux des produits sucrés.
- Les épisodes d’hypoglycémie sévère, avec perte de connaissance, peuvent être traités par administration intramusculaire ou sous-cutanée de glucagon (0,5 à 1 mg) par une personne formée à cet effet, ou par administration intraveineuse de glucose par le personnel médical. Si le patient ne répond pas au glucagon dans un délai de 10 à 15 minutes, du glucose devra être administré par voie intraveineuse. Dès que le patient a repris connaissance, une prise orale de glucides est recommandée afin de prévenir une rechute.
PHARMACODYNAMIE |
Classe pharmacothérapeutique : médicaments utilisés dans le diabète ; insulines et analogues pour injection, combinaison d’un analogue à action intermédiaire et d’un analogue à action rapide (code ATC : A10AD05).
NovoMix 30 est une suspension biphasique de 30 % d’insuline asparte soluble (analogue de l’insuline humaine à action rapide) et de 70 % d’insuline asparte protamine cristallisée (analogue de l’insuline humaine à action intermédiaire).
NovoMix 50 est une suspension biphasique de 50 % d’insuline asparte soluble (analogue de l’insuline humaine à action rapide) et de 50 % d’insuline asparte protamine cristallisée (analogue de l’insuline humaine à action intermédiaire).
NovoMix 70 est une suspension biphasique de 70 % d’insuline asparte soluble (analogue de l’insuline humaine à action rapide) et de 30 % d’insuline asparte protamine cristallisée (analogue de l’insuline humaine à action intermédiaire).
- Mécanisme d’action :
- L’effet hypoglycémiant de l’insuline asparte est dû à la liaison de l’insuline aux récepteurs des cellules musculaires et adipeuses facilitant ainsi l’assimilation du glucose et à l’inhibition simultanée de la production hépatique de glucose.
-
- NovoMix 30 :
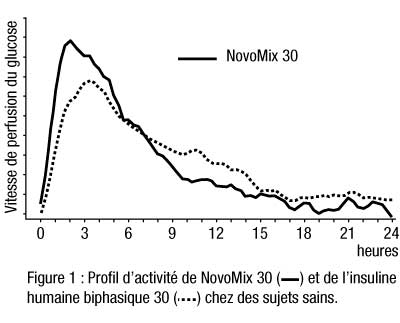
- NovoMix 30 est une insuline biphasique qui contient 30 % d’insuline asparte soluble. Grâce à son délai d’action rapide, on peut l’administrer plus près des repas (de 0 à 10 minutes avant/après le repas) que l’insuline humaine soluble. La phase cristalline (70 %) est constituée d’insuline asparte protamine cristallisée, dont le profil d’activité est similaire à celui de l’insuline humaine NPH (cf figure 1).
- Administré par voie sous-cutanée, NovoMix 30 commence à agir dans les 10 à 20 minutes qui suivent l’injection. Son effet maximum apparaît 1 à 4 heures après l’injection. Sa durée d’action peut atteindre 24 heures.
-

- Lors d’un essai sur 3 mois effectué chez des patients atteints de diabète de type 1 et de type 2, NovoMix 30 a montré un contrôle de l’hémoglobine glycosylée similaire à celui associé au traitement avec l’insuline humaine biphasique 30. En termes molaires, l’insuline asparte est équipotente à l’insuline humaine. NovoMix 30, administré avant le petit déjeuner et avant le dîner (repas du soir), a permis d’obtenir une glycémie postprandiale plus basse en comparaison à l’insuline humaine biphasique 30 administrée après les 2 repas (petit déjeuner et dîner).
- Une méta-analyse portant sur neuf études menées chez des patients diabétiques de type 1 et de type 2 a montré que la glycémie à jeun était plus élevée chez les patients traités par NovoMix 30 que chez les patients traités par insuline humaine biphasique 30.
- Dans une étude, 341 patients diabétiques de type 2 ont été randomisés entre un traitement par NovoMix 30 seul ou en association avec la metformine, ou un traitement par la metformine en association à un sulfamide hypoglycémiant. Le critère primaire d’efficacité – c’est-à-dire le taux d’HbA1c après 16 semaines de traitement – n’a pas été différent entre les patients traités par NovoMix 30 en association avec la metformine et les patients traités par la metformine en association à un sulfamide hypoglycémiant. Dans cette étude, 57 % des patients avaient une HbA1c de départ supérieure à 9 %. Dans ce groupe de patients, le taux d’HbA1c était significativement plus faible après traitement par NovoMix 30 en association à la metformine qu’après traitement par la metformine en association à un sulfamide hypoglycémiant.
- Dans une étude, des patients diabétiques de type 2, insuffisamment contrôlés sous antidiabétiques oraux seuls, ont été randomisés entre un traitement par NovoMix 30 deux fois par jour (117 patients) ou un traitement par l’insuline glargine une fois par jour (116 patients). Après 28 semaines de traitement correspondant aux recommandations de doses décrites dans la rubrique Posologie/Mode d’administration, la réduction moyenne d’HbA1c était de 2,8 % avec NovoMix 30 (moyenne d’HbA1c à l’inclusion = 9,7 %). 66 % et 42 % des patients traités par NovoMix 30 ont atteint un taux d’HbA1c inférieur à 7 % et 6,5 % respectivement, et la moyenne des glycémies à jeun a diminué d’environ 7 mmol/l (de 14,0 mmol/l à l’inclusion à 7,1 mmol/l).
- Une méta-analyse réalisée chez des patients diabétiques de type 2 a montré que NovoMix 30, en comparaison à l’insuline humaine biphasique 30, diminuait le risque global de survenue d’épisodes hypoglycémiques nocturnes ainsi que les hypoglycémies majeures. Le risque global d’épisodes hypoglycémiques diurnes était augmenté chez les patients traités par NovoMix 30.
-
- NovoMix 50 :
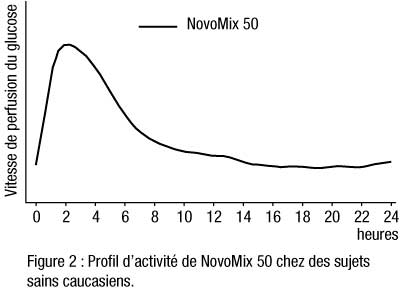
- NovoMix 50 est une insuline biphasique qui contient 50 % d’insuline asparte soluble. Grâce à son délai d’action rapide, on peut l’administrer plus près des repas (de 0 à 10 minutes avant/après le repas) que l’insuline humaine soluble. La phase cristalline (50 %) est constituée d’insuline asparte protamine cristallisée, dont le profil d’activité est similaire à celui de l’insuline humaine NPH.
-
- NovoMix 70 :
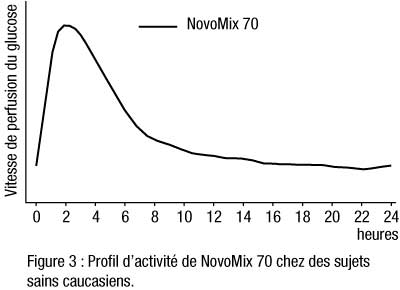
- NovoMix 70 est une insuline biphasique qui contient 70 % d’insuline asparte soluble. Grâce à son délai d’action rapide, on peut l’administrer plus près des repas (de 0 à 10 minutes avant/après le repas) que l’insuline humaine soluble. La phase cristalline (30 %) est constituée d’insuline asparte protamine cristallisée, dont le profil d’activité est similaire à celui de l’insuline humaine NPH.
-
- NovoMix 50 et NovoMix 70 :
- Administrés par voie sous-cutanée, NovoMix 50 et NovoMix 70 commencent à agir dans les 10 à 20 minutes qui suivent l’injection. Leur effet maximum apparaît 1 à 4 heures après l’injection. Leur durée d’action est de 14 à 24 heures (cf figures 2 et 3).
-

-

- En termes molaires, l’insuline asparte est équipotente à l’insuline humaine.
- Population pédiatrique :
-
- NovoMix 30 :
- Un essai clinique de 16 semaines comparant le contrôle glycémique postprandial sous NovoMix 30 administré lors des repas versus insuline humaine/insuline humaine biphasique 30 administré lors des repas et insuline NPH au coucher a été réalisé chez 167 sujets âgés de 10 ans à 18 ans. Le taux moyen d’HbA1c est resté similaire tout au long de l’étude dans les deux groupes de traitement, et il n’y a pas eu de différence du taux d’hypoglycémie avec NovoMix 30 ou l’insuline humaine biphasique 30.
- Dans un essai clinique en double aveugle et en cross-over (12 semaines de chaque traitement), mené sur une population plus restreinte (54 sujets) et plus jeune (de 6 à 12 ans), le taux d’épisodes hypoglycémiques et l’augmentation de la glycémie postprandiale étaient significativement plus faibles avec NovoMix 30 par rapport à l’insuline humaine biphasique 30. L’ HbA1c finale était significativement plus basse dans le groupe traité par l’insuline humaine biphasique 30 que dans le groupe NovoMix 30.
PHARMACOCINÉTIQUE |
- Absorption, distribution et élimination :
- La substitution de l’acide aminé proline par l’acide aspartique en position B28 de l’insuline asparte réduit la tendance à la formation d’hexamères comme ce qui est observé avec l’insuline humaine soluble.
-
- NovoMix 30 :
- L’insuline asparte de la phase soluble de NovoMix 30 représente 30 % de l’insuline totale ; elle est absorbée plus rapidement à partir du tissu sous-cutané que la fraction soluble de l’insuline humaine biphasique. Les 70 % restants sont constitués d’insuline asparte protamine cristallisée sous forme de cristaux, dont le profil d’absorption prolongée est similaire à celui de l’insuline humaine NPH.
- Avec NovoMix 30, la concentration maximale d’insuline sérique est en moyenne supérieure de 50 % à celle observée avec l’insuline humaine biphasique 30. En moyenne, le temps d’apparition de la concentration maximale est inférieur de moitié à celui de l’insuline humaine biphasique 30. Chez des volontaires sains, une concentration sérique maximale moyenne de 140 pmol/l ± 32 a été atteinte 60 minutes environ après injection sous-cutanée d’une dose de 0,20 U/kg de poids corporel. La demi-vie moyenne (t ½) de NovoMix 30, qui reflète la vitesse d’absorption de la fraction liée à la protamine, était de 8 à 9 heures environ. Le retour aux concentrations sériques de départ s’est fait en 15 à 18 heures après injection sous-cutanée de la dose. Chez les patients diabétiques de type 2, la concentration maximale a été atteinte 95 minutes environ après injection de la dose et des concentrations bien supérieures à zéro ont été mesurées 14 heures au moins après l’administration.
-
- NovoMix 50 :
- L’insuline asparte de la phase soluble de NovoMix 50 représente 50 % de l’insuline totale ; elle est absorbée plus rapidement à partir du tissu sous-cutané que la fraction soluble de l’insuline humaine biphasique. Les 50 % restants sont constitués d’insuline asparte protamine cristallisée sous forme de cristaux, dont le profil d’absorption prolongée est similaire à celui de l’insuline humaine NPH.
- Chez des volontaires sains, une concentration sérique maximale moyenne de 445 pmol/l ± 135 a été atteinte 60 minutes environ après injection sous-cutanée d’une dose de 0,30 U/kg de poids corporel. Chez les patients diabétiques de type 2, la concentration maximale a été atteinte 95 minutes environ après injection de la dose.
-
- NovoMix 70 :
- L’insuline asparte de la phase soluble de NovoMix 70 représente 70 % de l’insuline totale ; elle est absorbée plus rapidement à partir du tissu sous-cutané que la fraction soluble de l’insuline humaine biphasique. Les 30 % restants sont constitués d’insuline asparte protamine cristallisée sous forme de cristaux, dont le profil d’absorption prolongée est similaire à celui de l’insuline humaine NPH.
- Chez des volontaires sains, une concentration sérique maximale moyenne de 645 pmol/l ± 185 a été atteinte 60 minutes environ après injection sous-cutanée d’une dose de 0,30 U/kg de poids corporel. Chez les patients diabétiques de type 2, la concentration maximale a été atteinte 75 minutes environ après injection de la dose. Chez les patients diabétiques de type 1, une concentration sérique maximale moyenne de 721 pmol/l ± 184 a été atteinte 60 minutes environ après injection sous-cutanée d’une dose de 0,30 U/kg de poids corporel.
- Populations particulières :
- Les propriétés pharmacocinétiques de NovoMix 30 n’ont pas été étudiées chez les patients âgés ou les patients atteints de troubles rénaux ou hépatiques.
- Les propriétés pharmacocinétiques de NovoMix 50 et NovoMix 70 n’ont pas été étudiées chez les enfants, les patients âgés ou les patients atteints de troubles rénaux ou hépatiques.
- Population pédiatrique :
-
- NovoMix 30 :
- Les propriétés pharmacocinétiques de NovoMix 30 n’ont pas été étudiées chez les enfants ou les adolescents. Cependant, les propriétés pharmacocinétiques et pharmacodynamiques de l’insuline asparte soluble ont été étudiées chez des enfants (6 à 12 ans) et des adolescents (13 à 17 ans) atteints de diabète de type 1. L’insuline asparte a été absorbée rapidement dans les deux groupes, avec un Tmax équivalent à celui de l’adulte. Cependant, une variation de Cmax a été observée en fonction de l’âge, ce qui souligne l’importance de l’ajustement individuel des doses d’insuline asparte.
SÉCURITE PRÉCLINIQUE |
Les données non cliniques, issues des études conventionnelles de pharmacologie de sécurité, toxicologie en administration répétée, génotoxicité, et des fonctions de reproduction et de développement, n’ont pas révélé de risque particulier pour l’homme.
Lors des essais in vitro évaluant à la fois la liaison aux récepteurs de l’insuline et de l’IGF-1 et les effets sur la croissance cellulaire, l’insuline asparte s’est comportée de façon très similaire à l’insuline humaine. Les études ont aussi démontré que la dissociation de la liaison de l’insuline asparte sur le récepteur de l’insuline était équivalente à celle de l’insuline humaine.
INCOMPATIBILITÉS |
En l’absence d’études de compatibilité, ce médicament ne doit pas être mélangé à d’autres médicaments.
MODALITÉS DE CONSERVATION |
- Durée de conservation :
- 2 ans.
- A conserver au réfrigérateur (entre 2 °C et 8 °C). Maintenir à distance de l’élément de refroidissement. Ne pas congeler.
- Conserver la cartouche Penfill dans l’emballage extérieur, à l’abri de la lumière.
- Conserver le capuchon sur FlexPen, à l’abri de la lumière.
- Après la première ouverture ou gardé sur soi en réserve :
- Ne pas mettre au réfrigérateur. A conserver pendant 4 semaines au maximum à une température ne dépassant pas 30 °C.
- NovoMix doit être conservé à l’abri de la chaleur excessive et de la lumière.
MODALITÉS MANIPULATION/ÉLIMINATION |
Les aiguilles et NovoMix FlexPen ou NovoMix Penfill ne doivent pas être partagés. La cartouche ne doit pas être reremplie.
Après avoir sorti NovoMix du réfrigérateur, il est recommandé d’attendre que NovoMix arrive à température ambiante avant de remettre en suspension l’insuline comme précisé dans les instructions concernant la première utilisation.
NovoMix ne doit pas être utilisé si le liquide remis en suspension n’apparaît pas uniformément blanc et opaque. Il est nécessaire de préciser au patient qu’il est important de remettre en suspension NovoMix immédiatement avant de l’utiliser.
NovoMix ne doit pas être utilisé s’il a été congelé.
Le patient sera averti du fait qu’il doit jeter l’aiguille après chaque injection.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM | EU/1/00/142/004 ; CIP 3400935495259 (RCP rév 17.02.2011) NovoMix 30 Penfill. |
| EU/1/00/142/009 ; CIP 3400935676641 (RCP rév 17.02.2011) NovoMix 30 FlexPen. | |
| EU/1/00/142/015 ; CIP 3400937024297 (RCP rév 17.02.2011) NovoMix 50 FlexPen. | |
| EU/1/00/142/021 ; CIP 3400937165327 (RCP rév 17.02.2011) NovoMix 70 FlexPen. |
| Prix : | 41.40 euros (5 cartouches NovoMix 30 Penfill). |
| 43.18 euros (5 stylos NovoMix 30 FlexPen). | |
| 43.18 euros (5 stylos NovoMix 50 FlexPen). | |
| 43.18 euros (5 stylos NovoMix 70 FlexPen). | |
| Remb Séc soc à 65 %. Collect. | |
Titulaire de l’AMM : Novo Nordisk A/S, Danemark.
Représentant local :
NOVO NORDISK
Coeur Défense
100, av du Général-de-Gaulle
92400 Courbevoie
Tél : 01 41 97 66 00. Fax : 01 41 97 66 01
Info médic et pharma :
Tél Vert : 08 00 80 30 70
Site web : http://www.novonordisk.fr
Liste Des Sections Les Plus Importantes :
- pathologies
- Medicaments
- Medicaments injectables
- Traitement D’Urgence
- Guide Infirmier Des Examens De Laboratoire
- Infirmiers En Urgences
- Fiche Technique Medical
- Techniques De Manipulations En Radiologie Medicale
- Bibliotheque_medicale